

Un estudio del Centro de Investigaciones en Enfermedades Inflamatorias, que cuenta con el apoyo de la FAPESP, apunta que un fármaco que actualmente se aplica contra la fibrosis quística puede ayudar a prevenir las complicaciones de la infección causada por el nuevo coronavirus (imagen de NET arrojada por neutrófilo obtenida mediante miscroscopía confocal - CRID/ USP)
Un estudio del Centro de Investigaciones en Enfermedades Inflamatorias, que cuenta con el apoyo de la FAPESP, apunta que un fármaco que actualmente se aplica contra la fibrosis quística puede ayudar a prevenir las complicaciones de la infección causada por el nuevo coronavirus
Un estudio del Centro de Investigaciones en Enfermedades Inflamatorias, que cuenta con el apoyo de la FAPESP, apunta que un fármaco que actualmente se aplica contra la fibrosis quística puede ayudar a prevenir las complicaciones de la infección causada por el nuevo coronavirus
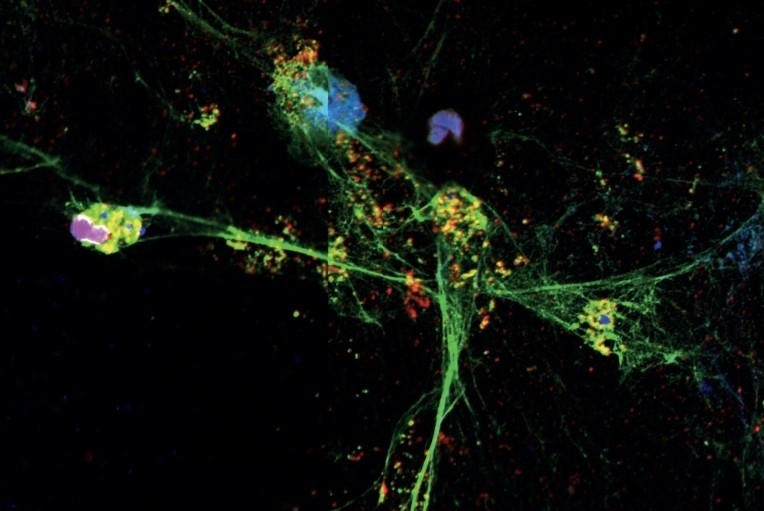
Un estudio del Centro de Investigaciones en Enfermedades Inflamatorias, que cuenta con el apoyo de la FAPESP, apunta que un fármaco que actualmente se aplica contra la fibrosis quística puede ayudar a prevenir las complicaciones de la infección causada por el nuevo coronavirus (imagen de NET arrojada por neutrófilo obtenida mediante miscroscopía confocal - CRID/ USP)
Por Karina Toledo | Agência FAPESP – Los pacientes acometidos por la forma grave de COVID-19 desarrollan una respuesta inflamatoria descontrolada y perjudicial para el organismo muy similar a la que se observa en casos de sepsis. Experimentos realizados en la Universidad de São Paulo (USP), en Brasil, a cargo de investigadores vinculados al Centro de Investigaciones en Enfermedades Inflamatorias (CRID), comprueban que en esas dos afecciones está implicado el mismo mecanismo inmunológico.
Este descubrimiento, detallado en un artículo dado a conocer en la plataforma medRxiv, aún sin revisión por pares, abre el camino hacia la formulación de nuevos abordajes terapéuticos, entre ellos el reposicionamiento de un fármaco que actualmente se aplica contra la fibrosis quística –cuyo principio activo es una enzima llamada DNasa– en el tratamiento de la infección provocada por el nuevo coronavirus (SARS-CoV-2).
“En las pruebas in vitro, realizadas con el plasma sanguíneo de pacientes internados con COVID-19 grave, la DNasa mostró capacidad para desactivar ese mecanismo inmunológico que puede provocar lesiones en órganos vitales. Ahora estamos evaluando con el laboratorio farmacéutico que produce el medicamento la factibilidad de iniciar un ensayo clínico”, comenta Fernando de Queiroz Cunha, coordinador del CRID, un Centro de Investigación, Innovación y Difusión (CEPID) financiado por la FAPESP con sede en la Facultad de Medicina de Ribeirão Preto (FMRP-USP).
Aunque se la conoce como una infección generalizada, la sepsis es a decir verdad una inflamación sistémica generalmente desencadenada por una infección bacteriana localizada que se ha salido de control. En un intento por combatir a los patógenos, el sistema inmunológico termina perjudicando al propio organismo. En sus formas más graves, los pacientes desarrollan lesiones que comprometen el funcionamiento de órganos vitales.
“Por ser una infección viral, el proceso inicial del COVID-19 es distinto. Pero a partir de un determinado momento, el cuadro se vuelve muy similar al de la sepsis. Los mediadores inflamatorios son los mismos y observamos que, en ambos casos, existe una participación de las NETs [trampas extracelulares de neutrófilos, por sus siglas en inglés]”, dice De Queiroz Cunha.
Tal como el propio nombre lo sugiere, las NETs constituyen una estrategia de defensa que utilizan fundamentalmente los neutrófilos, leucocitos capaces de fagocitar bacterias, hongos y virus y que componen la línea de frente del sistema inmunológico. En algunas situaciones, por motivos que aún no han sido comprendidos, se produce una activación de una enzima conocida como PAD-4, que migra hacia el núcleo de los neutrófilos e induce un aumento de la permeabilidad de la membrana nuclear. Esta enzima es fundamental para que el material genético existente en el núcleo se descomprima y forme redes que las células arrojan al medio extracelular con el objetivo de atrapar y matar a los potenciales invasores.
Este mecanismo inmunológico ya se había observado en pacientes con enfermedades autoinmunes y en infectados con el virus de la fiebre del chikunguña, una arbovirosis que también produce lesiones en tejidos. “El gran problema es que las NETs son tóxicas para los patógenos y también para las células humanas. La buena noticia indica que nuestros estudios muestran que la enzima DNasa es capaz de picotear esa red arrojada por los neutrófilos y evitar daños en los tejidos”, afirma De Queiroz Cunha.
Pruebas preclínicas
Estudios recientes mostraron que la infección causada por el SARS-CoV-2 puede causar lesiones en los pulmones, el corazón, los riñones, los nervios e incluso en la piel. Para confirmar la sospecha de que las NETs estarían involucradas en la agresión a los tejidos, los investigadores del CRID analizaron muestras del plasma sanguíneo de 32 pacientes internados y con COVID-19 y las compararon con las del plasma de personas sanas.
En los casos de los 17 participantes en el estudio que estaban internados en unidades de terapia intensiva (UTIs) y conectados a respiradores artificiales, fue posible extraer también muestras de la secreción que es expelida por los pulmones y que queda almacenada en los aparatos. Este trabajo contó con la colaboración de profesores de la FMRP-USP del área básica y también del área clínica. El grupo clínico está encabezado por el profesor Paulo Louzada Junior. Participaron también diversos doctorandos y posdoctorandos, entre ellos Flavio Protássio Veras, primer autor del trabajo.
“Vimos que el plasma sanguíneo de las personas internadas con COVID-19 está repleto de NETs y que la cantidad de esas trampas de neutrófilos en la secreción pulmonar es también 10 veces mayor. Esto sugiere que los neutrófilos están produciendo NETs por todo el organismo, pero que la producción está concentrada en los pulmones”, le comenta De Queiroz Cunha a Agência FAPESP.
Este hallazgo se confirmó en los análisis realizados con muestras de tejido pulmonar de personas que murieron como consecuencia del COVID-19, en el marco de una colaboración con el grupo encabezado por el profesor Paulo Saldiva en la Facultad de Medicina de la USP, en São Paulo. Mediante la aplicación de un método conocido como inmunofluorescencia, el grupo del CRID demostró que las NETs se encuentran presentes en grandes cantidades en los focos de inflamación existentes en esos órganos.
“En uno de los experimentos, aislamos neutrófilos procedentes de la sangre de personas sanas y los incubamos con el SARS-CoV-2. Fue entonces posible observar que, tan pronto como fueron infectadas, las células de defensa empezaron a producir NETs”, dice De Queiroz Cunha.
Posteriormente, esos neutrófilos infectados fueron dispuestos en cultivos de células epiteliales procedentes de tejido pulmonar humano, que murieron al cabo de algunas horas de interacción. El mismo efecto letal se detectó cuando se dispusieron los neutrófilos aislados en pacientes internados debido al COVID-19 en cultivos de células epiteliales pulmonares.
“Con todo, fue posible evitar la muerte de las células epiteliales cuando tratamos a los neutrófilos infectados con la enzima DNasa antes de ponerlos en el medio de cultivo”, comenta el investigador.
Aparte de la DNasa, que actúa para desestructurar la trampa de neutrófilos después que esta es arrojada desde las células de defensa, los investigadores también pusieron a prueba un compuesto con capacidad para inhibir la acción de la enzima PAD-4 y que, por ende, es capaz de evitar la formación de las NETs. También en ese caso el tratamiento previno la muerte de las células derivadas del epitelio pulmonar, pero la sustancia testeada aún no ha sido aprobada para su uso en humanos.
“Este trabajo exhibe evidencias de que la DNasa que actualmente se prescribe en el tratamiento de la fibrosis quística puede probarse en el combate contra la forma grave de COVID-19. Pero el hecho de que este fármaco se administre por vía inhalatoria dificulta el tratamiento de las personas intubadas. Lo ideal quizá sería tratar a los pacientes durante una fase más precoz, cuando empieza a bajar el nivel de oxigenación en la sangre”, sostiene De Queiroz Cunha.
Así y todo, el investigador remarca que aún se hará necesario realizar un ensayo clínico para testear la dosis ideal y el momento justo para empezar el tratamiento.
En colaboración con científicos del Laboratorio Nacional de Biociencias (LNBio), dependiente del Centro Nacional de Investigaciones en Energía y Materiales (CNPEM), el equipo del CRID también trabaja en el desarrollo de un nuevo compuesto con capacidad para inhibir la acción de la enzima PAD-4, que resulta esencial para la producción de las NETs dentro de los neutrófilos. Los resultados de esta investigación, cuyo objetivo inicial consistía en tratar la sepsis, se darán a conocer en breve.
Puede leerse el artículo intitulado SARS-CoV-2 triggered neutrophil extracellular traps (NETs) mediate COVID-19 pathology en el siguiente enlace: www.medrxiv.org/content/10.1101/2020.06.08.20125823v1.full.pdf.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





