

Estudo do Centro de Pesquisa em Doenças Inflamatórias da USP indica que fármaco atualmente usado contra fibrose cística pode ajudar a prevenir complicações da infecção pelo novo coronavírus (imagem da NET sendo lançada pelo neutrófilo obtida por miscroscopia confocal; imagem: CRID/USP)
Estudo do Centro de Pesquisa em Doenças Inflamatórias da USP indica que fármaco atualmente usado contra fibrose cística pode ajudar a prevenir complicações da infecção pelo novo coronavírus
Estudo do Centro de Pesquisa em Doenças Inflamatórias da USP indica que fármaco atualmente usado contra fibrose cística pode ajudar a prevenir complicações da infecção pelo novo coronavírus
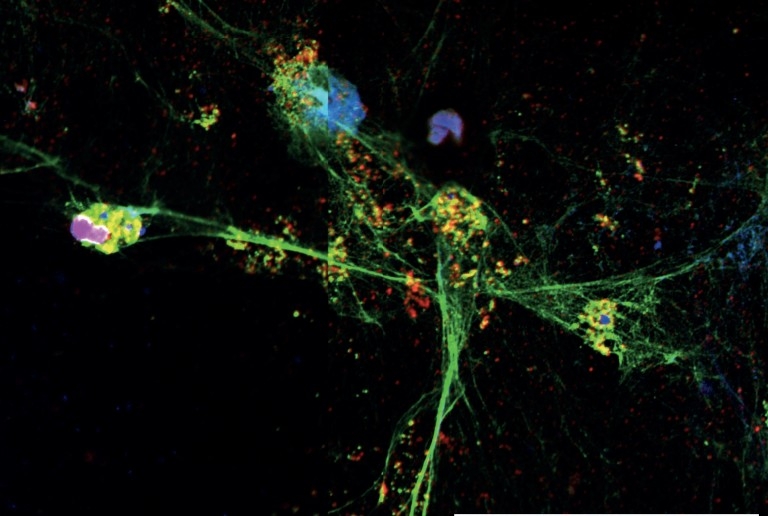
Estudo do Centro de Pesquisa em Doenças Inflamatórias da USP indica que fármaco atualmente usado contra fibrose cística pode ajudar a prevenir complicações da infecção pelo novo coronavírus (imagem da NET sendo lançada pelo neutrófilo obtida por miscroscopia confocal; imagem: CRID/USP)
Karina Toledo | Agência FAPESP* – Pacientes com a forma grave da COVID-19 desenvolvem uma resposta inflamatória descontrolada e lesiva ao organismo muito similar à observada em casos de sepse. Experimentos conduzidos no Centro de Pesquisa em Doenças Inflamatórias (CRID) da Universidade de São Paulo (USP) comprovam que, nessas duas enfermidades, o mesmo mecanismo imunológico está envolvido.
Detalhada em artigo divulgado no Journal of Experimental Medicine (JEM), a descoberta abre caminho para novas abordagens terapêuticas, entre elas o reposicionamento de um fármaco hoje usado contra fibrose cística – cujo princípio ativo é uma enzima chamada DNase – para o tratamento da infecção pelo novo coronavírus (SARS-CoV-2).
“Nos testes in vitro, feitos com o plasma sanguíneo de pacientes internados com COVID-19 grave, a DNase se mostrou capaz de desativar esse mecanismo imunológico que pode causar lesões em órgãos vitais. Agora estamos avaliando com o laboratório farmacêutico que produz o medicamento a viabilidade de iniciar um ensaio clínico”, conta Fernando de Queiroz Cunha, coordenador do CRID – um Centro de Pesquisa, Inovação e Difusão (CEPID) financiado pela FAPESP na Faculdade de Medicina de Ribeirão Preto (FMRP-USP).
Embora seja conhecida como infecção generalizada, a sepse é, na verdade, uma inflamação sistêmica geralmente desencadeada por uma infecção bacteriana localizada que saiu de controle. Na tentativa de combater os patógenos, o sistema imune acaba prejudicando o próprio organismo. Nas formas mais graves, os pacientes desenvolvem lesões que comprometem o funcionamento de órgãos vitais.
“Por ser uma infecção viral, o processo inicial da COVID-19 é diferente. Mas, a partir de certo momento, o quadro se torna muito semelhante ao da sepse. Os mediadores inflamatórios são os mesmos e observamos que, nos dois casos, há participação das NETs [armadilhas extracelulares neutrofílicas, na sigla em inglês]”, diz Cunha.
Como o próprio nome sugere, a NET é uma estratégia de defesa usada principalmente pelo neutrófilo, um tipo de leucócito capaz de fagocitar bactérias, fungos e vírus e que compõe a linha de frente do sistema imune. Em algumas situações, por motivos ainda não compreendidos, ocorre a ativação de uma enzima conhecida como PAD-4, que migra para o núcleo do neutrófilo e induz um aumento da permeabilidade da membrana nuclear. Esta enzima é fundamental para que o material genético contido no núcleo se descondense e forme redes, que são lançadas pela célula para o meio extracelular com o objetivo de prender e matar potenciais invasores.
Esse mecanismo imunológico já foi observado em pacientes com doenças autoimunes e nos infectados pelo vírus da febre chikungunya – uma arbovirose que também produz lesões em tecidos. “O grande problema é que a NET é tóxica para os patógenos e também para as células humanas. A boa notícia é que nossos estudos mostram que a enzima DNase é capaz de picotar essa rede lançada pelo neutrófilo, evitando danos aos tecidos”, afirma Cunha.
Ensaios pré-clínicos
Estudos recentes mostraram que a infecção pelo SARS-CoV-2 pode causar lesões nos pulmões, coração, rins, nervos e até na pele. Para confirmar a suspeita de que as NETs estariam envolvidas na agressão aos tecidos, os pesquisadores do CRID analisaram amostras do plasma sanguíneo de 32 pacientes internados por COVID-19 e compararam com o plasma de indivíduos saudáveis.
No caso dos 17 participantes do estudo que estavam internados em unidades de terapia intensiva (UTIs) e conectados a respiradores artificiais, foi possível coletar também amostras da secreção que é expelida pelos pulmões e fica armazenada no aparelho. O trabalho contou com a colaboração de professores da FMRP-USP da área básica e também da clínica. O grupo clínico é liderado pelo professor Paulo Louzada Junior. Participaram ainda diversos doutorandos e pós-doutorandos, entre eles Flavio Protássio Veras, primeiro autor do trabalho.
“Vimos que o plasma sanguíneo das pessoas internadas por COVID-19 está repleto de NETs e que a quantidade dessas armadilhas neutrofílicas na secreção pulmonar é ainda 10 vezes maior. Isso sugere que neutrófilos estão produzindo NETs por todo o organismo, mas a produção é concentrada nos pulmões”, conta Cunha à Agência FAPESP.
O achado foi confirmado nas análises feitas com amostras de tecido pulmonar de pessoas que morreram em decorrência da COVID-19, graças a uma parceria com o grupo liderado pelo professor Paulo Saldiva na Faculdade de Medicina da USP em São Paulo. Por um método conhecido como imunofluorescência, o grupo do CRID mostrou que as NETs estão presentes em grandes quantidades nos focos de inflamação existentes no órgão.
“Em um dos experimentos, isolamos neutrófilos do sangue de indivíduos saudáveis e incubamos com o SARS-CoV-2. Foi possível observar que, assim que foram infectadas, as células de defesa começaram a produzir NETs”, diz Cunha.
No artigo que será publicado no JEM, os pesquisadores descrevem que a entrada do vírus nos neutrófilos é dependente de duas proteínas: a ACE-2 (enzima conversora de angiotensina 2, na sigla em inglês) e a TMPRSS2 (serino-protease transmembranar). Esta última interage com a proteína spike presente na superfície do SARS-CoV-2. Segundo os autores, a ativação dessas vias de sinalização e o próprio ciclo replicativo viral são cruciais para a liberação das NETs.
Em seguida, esses neutrófilos infectados foram colocados em culturas de células epiteliais originárias de tecido pulmonar humano, que morreram após algumas horas de interação. O mesmo efeito letal ocorreu quando os neutrófilos isolados de pacientes internados por COVID-19 foram colocados na cultura de células epiteliais pulmonares.
“No entanto, foi possível evitar a morte das células epiteliais quando tratamos os neutrófilos infectados com a enzima DNase antes de colocá-los no meio de cultura”, conta o pesquisador.
Além da DNase, que atua para desestruturar a armadilha neutrofílica depois que ela é lançada pela célula de defesa, os pesquisadores também testaram um composto capaz de inibir a ação da enzima PAD-4 e, portanto, capaz de evitar a formação da NET. Também nesse caso o tratamento preveniu a morte das células derivadas do epitélio pulmonar, mas a substância testada ainda não foi aprovada para uso em humanos.
“Esse trabalho apresenta evidências de que a DNase hoje indicada para tratar fibrose cística pode ser testada no combate à forma grave da COVID-19. Mas o fato de o fármaco ser administrado por via inalatória dificulta o tratamento de pessoas intubadas. Talvez o ideal seja tratar o paciente em uma fase mais precoce, quando começar a baixar o nível de oxigenação no sangue”, avalia Cunha.
O pesquisador ressalta, porém, que ainda será necessário fazer um ensaio clínico para testar a dose ideal e o momento certo de começar a terapia.
Em parceria com pesquisadores do Laboratório Nacional de Biociências (LNBio) do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM), a equipe do CRID também trabalha no desenvolvimento de um novo composto capaz de inibir a enzima PAD-4, cuja ação é essencial para a produção da NET dentro do neutrófilo. Os resultados da pesquisa, cujo objetivo inicial era tratar sepse, devem ser divulgados em breve.
O artigo SARS-CoV-2 triggered neutrophil extracellular traps (NETs) mediate COVID-19 pathology pode ser lido em https://rupress.org/jem/article/217/12/e20201129/152086/SARS-CoV-2-triggered-neutrophil-extracellular?searchresult=1.
* Texto atualizado em 14 de setembro de 2020.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





