

As imagens mostram a marcação de organelas responsáveis pelo processo de degradação autofágica em células, os autofagosomos (em amarelo) e sua forma madura, os autolisosomos (em vermelho). Podemos ver que a célula com menos NCLX (direita) possui menos marcação do que uma célula normal (esquerda), demonstrando falha na formação dessas organelas (crédito: Vitor de Miranda Ramos)
Artigo publicado por grupo do Centro de Processos Redox em Biomedicina revela a ligação entre o transporte de cálcio no interior das mitocôndrias e o processo de autofagia, pelo qual a célula degrada e reaproveita parte de seus componentes
Artigo publicado por grupo do Centro de Processos Redox em Biomedicina revela a ligação entre o transporte de cálcio no interior das mitocôndrias e o processo de autofagia, pelo qual a célula degrada e reaproveita parte de seus componentes
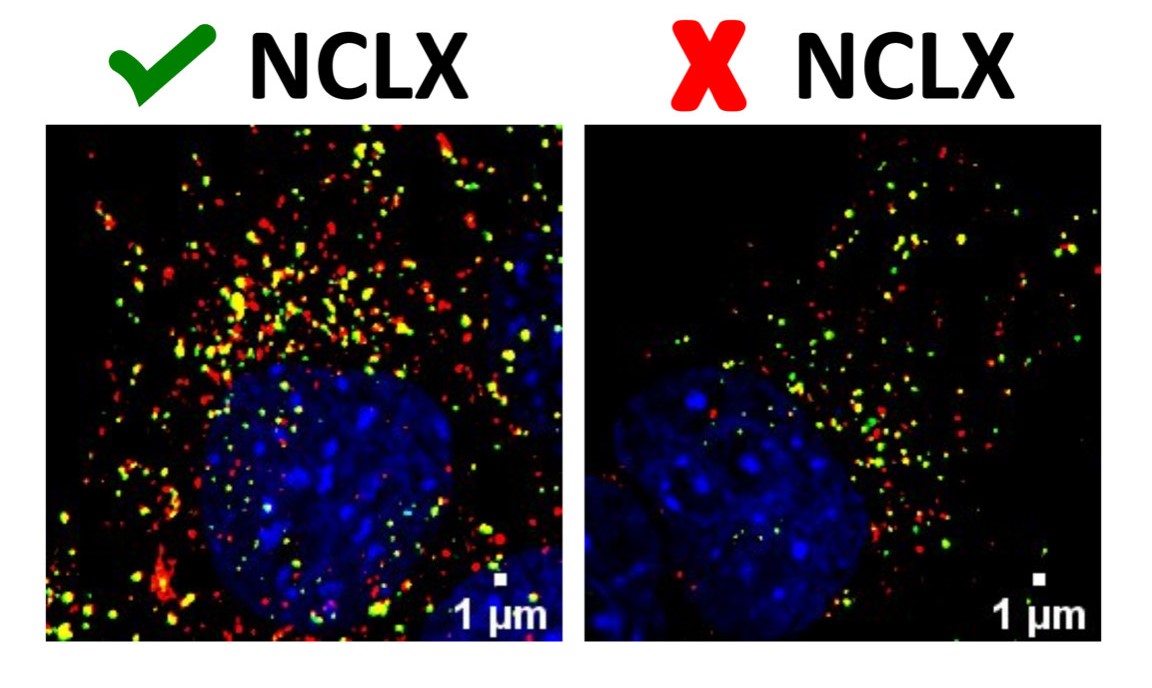
As imagens mostram a marcação de organelas responsáveis pelo processo de degradação autofágica em células, os autofagosomos (em amarelo) e sua forma madura, os autolisosomos (em vermelho). Podemos ver que a célula com menos NCLX (direita) possui menos marcação do que uma célula normal (esquerda), demonstrando falha na formação dessas organelas (crédito: Vitor de Miranda Ramos)
Agência FAPESP* – Estudo brasileiro divulgado no Faseb Journal ajuda a entender como se correlacionam dois processos fundamentais na regulação do metabolismo energético: a captação e liberação de íons de cálcio pela mitocôndria (organela que gera energia para as células) e a autofagia (processo pelo qual a célula degrada e reaproveita partes de seu próprio citoplasma) induzida por restrição calórica.
O trabalho foi conduzido no Centro de Processos Redox em Biomedicina (Redoxoma) – um Centro de Pesquisa, Inovação e Difusão (CEPID) da FAPESP sediado no Instituto de Química da Universidade de São Paulo (IQ-USP).
Liderado pela professora Alicia Kowaltowski, os pesquisadores do Redoxoma demonstraram que o transportador responsável pelo efluxo de íons de cálcio das mitocôndrias, a proteína NCLX, é um importante nó regulador que integra mitocôndrias, controle de autofagia por íons de cálcio e respostas celulares à disponibilidade de nutrientes. Com isso, eles estabeleceram a ligação entre a autofagia e o cálcio mitocondrial.
“Esse trabalho é importante porque fizemos o link entre esses processos. Tanto a mitocôndria quanto a autofagia estão envolvidas no metabolismo e, portanto, faz sentido que exista uma coordenação entre elas. Normalmente, quando a gente estuda biologia celular, as coisas são vistas separadamente, mas precisamos lembrar que, nas células, um processo depende do outro, regula o outro. E, apesar de ser um trabalho de ciência básica, que parece meio abstrato, esse conhecimento com certeza pode ser usado em contextos patológicos para o desenvolvimento de alvos terapêuticos”, afirma Vitor de Miranda Ramos, pesquisador do Redoxoma e primeiro autor do artigo.
Ramos realizou parte do estudo no laboratório do professor Viktor Korolchuk, da Newcastle University (Inglaterra), com apoio de Bolsa Estágio de Pesquisa no Exterior (BEPE) da FAPESP.
Além de gerar energia para as células, as mitocôndrias participam diretamente de várias vias de regulação celular sensíveis ao cálcio, pois são capazes de captar, absorver e liberar íons de cálcio. A captação mitocondrial de íons de cálcio é mediada pelo complexo uniporter mitocondrial de cálcio (MCU), enquanto o trocador mitocondrial Na+/Li+/Ca2+ (NCLX) move íons de cálcio da matriz mitocondrial para o espaço entre a membrana interna e a externa, em troca de íons de sódio.
O cálcio afeta quase todos os aspectos da vida celular. Íons de cálcio são segundos mensageiros conhecidos na sinalização metabólica e desempenham um papel importante na regulação da autofagia.
Reciclagem celular
A autofagia é um processo evolutivamente conservado de degradação e reciclagem de componentes celulares, tendo o papel basal de manutenção da homeostase celular. Por sua habilidade em remover elementos indesejados e promover a disponibilidade de nutrientes, a autofagia é necessária para controle de qualidade, renovação tecidual e regulação metabólica.
Além da função basal, a autofagia também é ativada em resposta à diminuição da disponibilidade de nutrientes, sendo considerada um dos mecanismos responsáveis pelos benefícios da restrição calórica.
No trabalho, como ponto de partida para entender a interação entre o transporte mitocondrial de cálcio e a autofagia, os pesquisadores submeteram camundongos a quatro meses de restrição calórica e observaram que as mitocôndrias isoladas do fígado desses animais continham níveis mais elevados de NCLX do que as dos animais submetidos a uma dieta com acesso ilimitado ao alimento.
A partir disso, usando células de fígado em cultura, criaram modelos para mimetizar a restrição calórica e, novamente, observaram o aumento da expressão de NCLX.
Mecanismo
A partir de diferentes medidas realizadas em várias etapas do processo de autofagia, os pesquisadores descobriram que a atividade de NCLX afeta os passos iniciais da maquinaria autofágica. Na autofagia, componentes celulares são sequestrados por autofagossomos (estrutura que a célula cria para englobar os componentes que serão degradados), que por sua vez se fundem com lisossomos para promover a digestão de organelas ou proteínas. Com os dados obtidos no estudo, os pesquisadores concluíram que a alteração do cálcio intracelular resultante da inativação de NCLX interfere na formação do autofagossomo, prejudicando as etapas iniciais da autofagia.
Diferentemente do que seria esperado, os pesquisadores também viram que a inibição de NCLX não alterou a produção de ATP (trifosfato de adenosina, molécula usada na produção de energia) nas mitocôndrias, nem afetou a via da proteína quinase ativada por AMP (AMPK), que é ativada quando a energia está baixa na célula. “Na verdade, essa regulação da autofagia pelo NCLX está acontecendo pelo cálcio celular independente dessa via”, diz Kowaltowski.
Segundo os pesquisadores, mais estudos são necessários para elucidar os complexos mecanismos de controle da autofagia pelo cálcio citoplasmático. “Obviamente, a sinalização do cálcio é muito complexa, talvez promíscua na célula, pois muitas proteínas podem se ligar ao cálcio e ser reguladas por ele, então é difícil chegar a um mecanismo específico”, comenta Ramos.
O cérebro usa muita energia e precisa de muitas mitocôndrias. O acúmulo de danos nas células pode levar à morte celular e ao desenvolvimento de patologias. “Apesar de não termos olhado especificamente para contextos patológicos, esse link entre a sinalização de cálcio e a autofagia é interessante porque pode ser uma ideia de progressão em alguma doença. Ao perder a atividade desse transportador, mais danos são gerados, e o processo para limpar esses danos – a autofagia – está prejudicado. Isso abre perspectivas para trabalhos futuros”, destaca Kowaltowski.
O artigo Mitochondrial sodium/calcium exchanger (NCLX) regulates basal and starvation-induced autophagy through calcium signaling pode ser lido em https://faseb.onlinelibrary.wiley.com/doi/10.1096/fj.202301368RR.
* Com informações do Redoxoma.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





