

La imagen visualizada en un microscopio de fluorescencia muestra núcleos de células de la retina (a la izq. de la flecha) y del epitelio ciliar (a la der. de la flecha) de un ratón (imagen: Dânia Emi Hamassaki)
Científicos sugieren mecanismos tendientes a estimular a las células del epitelio ciliar para que proliferen y regresen al estado progenitor
Científicos sugieren mecanismos tendientes a estimular a las células del epitelio ciliar para que proliferen y regresen al estado progenitor
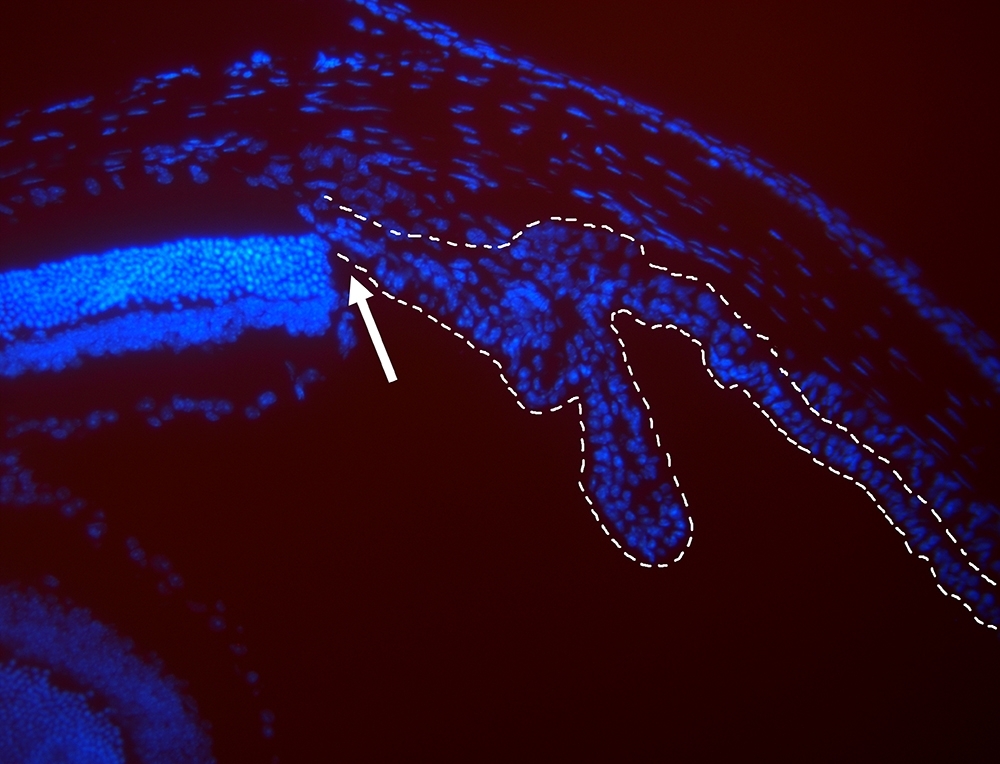
La imagen visualizada en un microscopio de fluorescencia muestra núcleos de células de la retina (a la izq. de la flecha) y del epitelio ciliar (a la der. de la flecha) de un ratón (imagen: Dânia Emi Hamassaki)
Por Elton Alisson
Agência FAPESP – En el ojo humano existe una estructura que se sitúa entre la retina y la raíz del iris llamada cuerpo ciliar, encargada de la acomodación del cristalino y de la formación del humor acuoso, el líquido incoloro que ocupa las cámaras oculares y mantiene la presión intraocular.
El cuerpo ciliar está revestido por un tejido (epitelio) formado por dos capas de células, el epitelio ciliar.
Hace alrededor de 15 años se descubrió que esa estructura también posee células quiescentes (inactivas) que, en condiciones específicas, pueden ser estimuladas a convertirse en células madre o progenitoras, capaces de proliferar y diferenciarse en tipos celulares perdidos como consecuencia de la degeneración de la retina.
Ahora, en el marco de un estudio realizado por científicos del Departamento de Biología Celular y del Desarrollo del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (ICB-USP) surgieron posibles formas de estimular la proliferación o la reprogramación de esas células del epitelio ciliar en ratones.
Los resultados de esta investigación, realizada en el ámbito de un proyecto apoyado por la FAPESP, salieron publicados en la revista Investigative Ophthalmology & Visual Science.
“Observamos que el tipo de estímulo de una de las vías de señalización de células del epitelio ciliar lleva a un aumento de la proliferación o del perfil progenitor de esas células”, declaró Dânia Emi Hamassaki, docente del ICB-USP y coordinadora del proyecto, a Agência FAPESP.
Los investigadores activaron e inactivaron proteínas de señalización pertenecientes a la familia Rho de GTPasas, expresadas en el epitelio celular de ratones.
Esta familia de proteínas regula diversas vías de señalización que controlan la transcripción de genes, aparte de la sobrevivencia y la proliferación de células, según indican los autores de la investigación.
Con el fin de evaluar el efecto de estas proteínas en la regulación del ciclo celular y en la expresión de genes progenitores en el epitelio ciliar, los investigadores expresaron y activaron las GTPasas RhoA, RhoB y Rac1 en las células del epitelio ciliar de ratones mediante inyecciones intraoculares de ácido lisofosfatídico (LPA), un lípido bioactivo que desempeña un importante rol en diversos procesos, tales como la proliferación, la migración y la muerte celular.
En otro experimento, inhibieron las proteínas con toxina A de Clostridium difficile, una bacteria que está presente naturalmente en la flora intestinal humana.
Los resultados de los experimentos indicaron que la inhibición de las GTPasas provocó la proliferación de células progenitoras retinianas en el epitelio ciliar.
En tanto, la activación de las GTPasas a cargo del ácido lisofosfatídico indujo el aumento de células progenitoras retinianas en el epitelio ciliar, pero no tuvo ninguna influencia sobre la proliferación de este tipo de célula en esa región ocular.
“Constatamos que la modulación de esos dos mecanismos distintos, de proliferación y de reprogramación de células del epitelio ciliar, puede suministrar un potencial nuevo abordaje para la reparación de tejidos retinianos”, dijo Hamassaki.
Regeneración limitada
De acuerdo con la investigadora, las células del epitelio ciliar, junto a las células gliales de Müller encontradas en la propia retina, han sido apuntadas como potenciales blancos terapéuticos para contribuir a la neurogénesis (la formación de nuevas neuronas retinianas) en adultos, en razón de sus propiedades de células madre y progenitoras.
Si bien es un mecanismo biológico relativamente conservado, la capacidad de regeneración de las neuronas perdidas al cabo de lesiones de la retina –que ocurren en los casos de glaucoma, retinopatía diabética y degeneración macular, por ejemplo– varía entre las diversas especies de animales, explicó Hamassaki.
“En concordancia con la evolución, los animales fueron perdiendo la capacidad de regeneración de neuronas retinianas, que está muy bien establecida en peces y anfibios, y es mucho más limitada en aves y mamíferos”, comparó.
Una de las hipótesis para la pérdida progresiva de la capacidad de regeneración neuronal, según la investigadora, reside en la existencia de algún mecanismo inhibitorio que les impide a las células de la propia retina (células gliales) o del epitelio ciliar de algunos animales, por ejemplo, proliferar y diferenciarse en neuronas.
Para identificar este mecanismo, la posdoctoranda Carolina Beltrame Del Debbio realiza un proyecto con Beca de la FAPESP, bajo la dirección de Hamassaki.
Al entender mejor este mecanismo de inhibición y de qué modo mueren las neuronas retinianas y pueden ser reparadas, sería posible manipular células del epitelio ciliar y las células gliales, de manera tal que pudiesen proliferar y diferenciarse en tipos celulares que se perdieron dentro de la retina, apuntó Hamassaki.
“Esta estrategia de reprogramación de células retinianas o del epitelio ciliar para desempeñar funciones de tipos celulares perdidos debido a la degeneración retiniana es bastante interesante, pues son células que ya están en su propio microambiente”, sostuvo la investigadora.
Puede leerse el artículo Rho GTPases Control Ciliary Epithelium Cells Proliferation and Progenitor Profile Induction In Vivo (doi: 10.1167/iovs.13-13162), de Hamassaki y otros, en la revista Investigative Ophthalmology & Visual Science, en: www.iovs.org/content/55/4/2631.abstract.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





