

En un artículo publicado en la revista Chemistry & Biology, investigadores describen el mecanismo inédito de inhibición de la actividad del proteasoma, el complejo proteico al que se considera un blanco terapéutico contra el cáncer
En un artículo publicado en la revista Chemistry & Biology, investigadores describen el mecanismo inédito de inhibición de la actividad del proteasoma, el complejo proteico al que se considera un blanco terapéutico contra el cáncer
En un artículo publicado en la revista Chemistry & Biology, investigadores describen el mecanismo inédito de inhibición de la actividad del proteasoma, el complejo proteico al que se considera un blanco terapéutico contra el cáncer
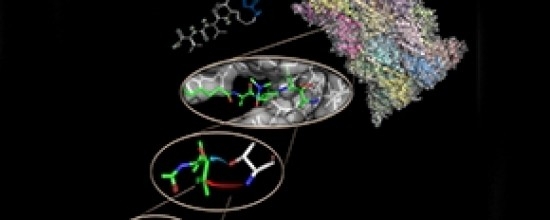
En un artículo publicado en la revista Chemistry & Biology, investigadores describen el mecanismo inédito de inhibición de la actividad del proteasoma, el complejo proteico al que se considera un blanco terapéutico contra el cáncer
Por Karina Toledo
Agência FAPESP – Un nuevo mecanismo de inhibición del proteasoma –un complejo proteico considerado como un blanco terapéutico contra el cáncer– es el tema de un artículo publicado en la revista Chemistry & Biology. La primera autora del trabajo es la brasileña Daniela Trivella, investigadora del Laboratorio Nacional de Biociencias del Centro Nacional de Investigación en Energía y Materiales (LNBio/ CNPEM).
Los resultados de este estudio, llevado a cabo con el apoyo de la FAPESP y con la colaboración científicos de la University of California con sede en San Diego, en Estados Unidos, y de la Technische Universität München, de Alemania, abren el camino rumbo al desarrollo de una nueva generación de drogas quimioterapéuticas más eficientes y menos tóxicas.
“Hemos diseñado una serie de moléculas con base en este nuevo mecanismo identificado. Pretendemos ahora sintetizarlas en colaboración con la investigadora Marjorie Bruder, también del CNPEM, y testar su potencia. El objetivo consiste en optimizar el efecto de inhibición del proteasoma, tornar al compuesto más selectivo aún para las células tumorales y sortear los problemas de resistencia observados en las drogas disponibles en el mercado”, comentó Trivella.
El proeteasoma, perteneciente a un tipo de enzimas conocidas como proteasas, es un complejo proteico que se encarga de realizar diversas funciones importantes en el interior de las células, tales como la eliminación de proteínas dañadas o no funcionales y la regulación de procesos de apoptosis (o muerte programada), división y proliferación celular.
Desde la aprobación del fármaco bortezomib en 2003, quedó demostrado que moléculas capaces de inhibir a actividad del proteasoma matan a las células tumorales con gran eficiencia y tienen un efecto menor sobre las células sanas.
“Las células del cáncer son más dependientes del proteasoma que las restantes, pues su metabolismo es acelerado y su tasa de división y proliferación es alta; por eso viven en un estado crónico de estrés oxidativo y proteico. Terminan sintetizando proteínas en exceso, muy rápido y con baja calidad. El proteasoma es el gran basurero que intenta limpiar la suciedad de la célula tumoral”, comentó Trivella.
Asimismo, añadió la investigadora, se sabe que, al inhibir el proteasoma, es posible aumentar las tasas de apoptosis y disminuir las de división y proliferación celular, que se encuentran alteradas en el tumor.
Aunque el bortezomib ha venido siendo empleado exitosamente desde entonces, fundamentalmente en el tratamiento de mieloma múltiple (cáncer de la medula ósea), la droga presenta efectos colaterales importantes, entre los cuales cobra relevancia la neuropatía periférica, caracterizada por producir hormigueo, dolor o pérdida de sensibilidad en los brazos y piernas.
De acuerdo con Trivella, esto sucede porque el quimioterapéutico inhibe no solamente el funcionamiento del proteasoma, sino también el de otras proteasas importantes para el organismo.
En 2012 se aprobó el fármaco carfilzomib, inspirado en una molécula natural llamada epoxomicina. Pese a ser más selectivo y eficaz contra el cáncer, este medicamento inhibe el proteasoma en forma irreversible, tanto en las células tumorales como en las sanas, lo que complica su uso prolongado, en razón de su alta toxicidad.
Con el tiempo, comentó Trivella, se verificó que ciertas mutaciones en el proteasoma y mecanismos bioquímicos alternativos le confirieron al tumor resistencia a las drogas disponibles en el mercado. Asimismo, esa primera generación de inhibidores no tiene mucho efecto en el tratamiento de tumores sólidos, lo que limita su aplicación.
En busca de alternativas
También en 2012, investigadores estadounidenses y brasileños aislaron en cianobacterias oriundas del Caribe una molécula natural denominada carmaficina, que posee el mismo grupo reactivo (la fracción de la molécula que interactúa con el proteasoma) del carfilzomib, conocido como epoxicetona.
“Las epoxicetonas son inhibidores muy potentes y selectivos del proteasoma, pues interactúan con esta enzima en dos etapas de reacción: la primera es una fase reversible, en tanto que la segunda es irreversible”, explicó Trivella.
Con todo, más allá de inhibir el proteasoma de manera irreversible, este compuesto presentaba ciertos problemas de inestabilidad química. Con el objetivo de optimizar su efecto y hallar nuevos grupos reactivos, científicos del Scripps Institution of Oceanography, de la University of California en San Diego, desarrollaron una serie de similares sintéticos con pequeñas modificaciones estructurales.
Trivella sometió a pruebas estos compuestos durante su pasantía en California, en el marco de su posdoctorado, cuando aún se encontraba vinculada al Instituto de Química de la Universidad de Campinas (Unicamp).
“Mi misión consistía en comparar la potencia de los distintos compuestos. En caso de que encontrásemos algo interesante, iniciaríamos estudios más profundos. A tal fin, se realizaron curvas de concentración-respuesta, en las cuales se verifica la concentración de la droga necesaria para causar la inactivación del 50% del proteasoma (IC50), o en experimentos paralelos, la muerte del 50% de las células tumorales en cultivo”, comentó la investigadora.
Una de las moléculas testeadas tenía como grupo reactivo una enona y reunía las características de la carmaficina y de otra molécula natural denominada siringolina, aislada a partir de un patógeno de plantas.
“La siringolina ya había sido reportada como inhibidora irreversible del proteasoma en una única etapa de la reacción, con IC50 en el orden de micromolar, lo que no es muy potente. Pretendíamos verificar los efectos de la combinación del esqueleto químico de la carmaficina con grupos reactivos más similares al de la siringolina. Imaginábamos que esa nueva molécula con grupo reactivo enona tendría un efecto parecido, pero fue 10 veces más potente que la siringolina”, dijo Trivella.
Al investigar los mecanismos de reacción de la nueva molécula –denominada carmaficina-siringolina enona–, la investigadora verificó que, a diferencia de la siringolina y al igual que la epoxicetona, la enona interactúa con el proteasoma en dos etapas, y la segunda reacción es de tipo irreversible.
No obstante, Trivella observó que, en el caso de la enona, la segunda reacción transcurre de forma más lenta, lo que aumenta la duración de la etapa reversible de la inhibición de la carmaficina-siringolina enona.
“Como la inactivación irreversible del proteasoma tiene efectos tóxicos, la mayor ventana de reversibilidad observada para la carmaficina-siringolina enona reducirá potencialmente la toxicidad de este nuevo tipo de inhibidores del proteasoma”, dijo Trivella. “El compuesto presentaría así un equilibrio entre selectividad y potencia.”
Las pruebas de toxicidad aún están en marcha, según Trivella. Simultáneamente, se llevaron a cabo estudios mediante el empleo de técnicas de cristalografía (que consisten en formar un cristal a base de soluciones concentradas de la enzima de interés purificada y estudiarlo entonces por difracción de rayos X) para develar exactamente cómo transcurre la interacción entre el blanco enzimático y el inhibidor carmaficina-siringolina enona.
“Descubrimos que se produce una reacción química llamada hidroaminación, que nunca antes se había observado en condiciones fisiológicas. Este tipo de reacción es muy usada por los químicos sintéticos en la preparación de sustancias; pero, normalmente, se hacen necesarias condiciones muy específicas de temperatura y de pH, y el uso de catalizadores para que se concrete. Como mecanismo de inhibición enzimática nunca había sido reportado”, dijo Trivella.
Inspirado por ese nuevo mecanismo de inhibición del proteasoma, el grupo del LNBio planea sintetizar y probar una nueva serie de análogos de la carmaficina-siringolina enona, para verificar efectos sobre la ventana terapéutica (la muerte preferencial de células tumorales con relación a las células sanas) y evaluar si son capaces de reaccionar también con proteasomas resistentes a los inhibidores tradicionales.
Otra meta de Trivella consiste en buscar en la biodiversidad brasileña compuestos naturales que puedan servir de inspiración para el diseño de otros tipos de inhibidores del proteasoma.
“Necesitamos un poco de la inspiración de la naturaleza para ampliar las opciones de grupos reactivos y de estructura de moléculas. Al analizar la diversidad química disponible en nuestra biodiversidad aumentarán nuestras posibilidades de hallar alternativas aún más innovadoras para optimizar propiedades tales como la potencia, la selectividad y la farmacocinética”, afirmó.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





