
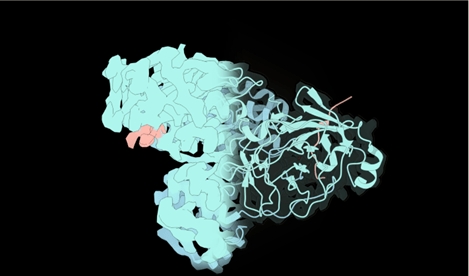
Mapa de criomicroscopia do dímero da proteína Mpro em interação com o N-terminal (imagem: acervo dos pesquisadores)
Resultados divulgados por pesquisadores da USP e colaboradores na revista Nature Communications devem impactar o desenvolvimento de fármacos contra a COVID-19
Resultados divulgados por pesquisadores da USP e colaboradores na revista Nature Communications devem impactar o desenvolvimento de fármacos contra a COVID-19

Mapa de criomicroscopia do dímero da proteína Mpro em interação com o N-terminal (imagem: acervo dos pesquisadores)
Agência FAPESP – Artigo publicado na revista Nature Communications revela novos detalhes sobre o processo de maturação da proteína Mpro, essencial para o ciclo de vida do vírus SARS-CoV-2 e alvo de vários estudos voltados ao desenvolvimento de fármacos para o tratamento da COVID-19.
A investigação foi conduzida por pesquisadores do Instituto de Física de São Carlos da Universidade de São Paulo (IFSC-USP), no âmbito do Centro de Pesquisa e Inovação em Biodiversidade e Fármacos (CIBFar), que é apoiado pela FAPESP por meio do programa Centros de Pesquisa, Inovação e Difusão (CEPIDs). Colaboraram equipes da Universidade de Oxford, no Reino Unido, e do Laboratório Nacional de Luz Síncrotron, que pertence ao Centro Nacional de Pesquisa em Energia e Materiais (LNLS-CNPEM).
Como explicam os autores, o nome Mpro é um acrônimo em inglês para o termo main protease (protease principal), que faz alusão à importância dessa proteína para o vírus. Atualmente, dois remédios disponíveis no mercado para tratar a COVID-19 interagem com essa molécula. Apesar disso, a atividade da proteína Mpro ainda não era totalmente compreendida. Os novos detalhes foram revelados agora por meio de experimentos conduzidos no Sirius, o acelerador de partículas de última geração instalado no LNLS-CNPEM, em Campinas.
Para atuar no ciclo de vida do SARS-CoV-2, a Mpro passa por uma série de modificações até chegar à sua forma final. Parte do processo já havia sido revelada pelo grupo de São Carlos, comandado pelo professor Glaucius Oliva.
Um dos líderes da empreitada, o ex-bolsista da FAPESP Andre Schutzer de Godoy, levou, em setembro de 2020, cerca de 200 cristais com proteínas do novo coronavírus para serem analisados na linha de luz do Sirius conhecida como Manacá, projetada para experimentos de cristalografia com difração de raios X.
“A linha de luz Manacá foi a primeira estação de pesquisa a ser aberta no Sirius, como resultado de um esforço do CNPEM para apoiar pesquisas que buscassem elucidar mecanismos moleculares relacionados com a COVID-19. Este trabalho é uma das publicações que resultaram desse esforço”, contou Harry Westfahl, diretor do LNLS, à Assessoria de Comunicação do CNPEM.
Os resultados do primeiro artigo, divulgado no Journal of Molecular Biology em 2021, já revelavam detalhes relevantes do processo de maturação da principal protease do SARS-CoV-2, mas ainda não o descreviam por completo.
“Naquele primeiro estudo, com os dados de cristalografia obtidos no Sirius, nós visualizamos e compreendemos os três últimos passos da maturação da Mpro, necessários para que essa proteína atinja sua forma final. Contudo, naquela ocasião, não conseguimos compreender o primeiro passo da maturação, que é muito rápido”, explicou Godoy.
As pesquisas com a Mpro prosseguiram e foram aprofundadas, inclusive com colaboração internacional e financiamento do National Institutes of Health (NIH) dos Estados Unidos. Também apoiam essa pesquisa a FAPESP (projeto 15/16811-3), a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) e o fundo inglês Welcome Trust.
Técnicas empregadas
Para compreender como a proteína passa de sua forma inativa à ativa, os pesquisadores combinaram técnicas de última geração, como espectrometria de massa nativa (que permite medir peso molecular e identificar seus componentes), criomicroscopia eletrônica (que produz imagens tridimensionais das moléculas congeladas) e cristalografia por difração de raios X (que revela a estrutura com resolução atômica).
“As análises realizadas no Sirius, por meio de cristalografia, permitiram demonstrar que a proteína consegue atingir seu estado final da maturação mesmo sem processamento na sua região N-terminal [uma das extremidades da cadeia polipeptídica]. O resultado foi uma surpresa. Além disso, fomos capazes de elucidar uma proteína pequena, com menos de 70 kDa [quilodaltons, unidade de massa atômica], pela técnica de criomicroscopia e detalhar a interação com a porção N-terminal em solução”, contou Godoy.
Como atuam os inibidores de Mpro
Ainda no Sirius, os pesquisadores analisaram a interação da Mpro com dois diferentes inibidores, um deles já em uso no tratamento da COVID-19. Os resultados demonstraram como as drogas funcionam de maneira distinta no nível molecular. O inibidor não covalente impede a dimerização da proteína e, assim, impacta diretamente a maturação da molécula e sua atividade. Já o inibidor covalente induz a conversão de monômeros em dímeros, mesmo com terminais N intactos.
“Explicar como a Mpro interage com seus inibidores impacta diretamente os estudos voltados ao desenvolvimento de drogas contra a COVID-19 que têm como alvo essa proteína”, disse Gabriela Noske, doutoranda na USP São Carlos e primeira autora do trabalho.
O grupo pretende continuar usando técnicas combinadas para aprofundar estudos de outros inibidores para outros vírus, considerando o risco de enfrentarmos novas epidemias ou pandemias no futuro. Além disso, continua buscando novos inibidores para o SARS-CoV-2 no âmbito do Consórcio COVID Moonshot, um projeto colaborativo de ciência aberta iniciado em março de 2020 com o objetivo de desenvolver um medicamento antiviral oral não patenteado.
O artigo An in-solution snapshot of SARS-COV-2 main protease maturation process and inhibition pode ser acessado em: www.nature.com/articles/s41467-023-37035-5.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





