

Imagens de microscopia eletrônica de transmissão de nanoesferas (A e B) e de nanoestrelas de ouro (C e D) conjugadas com a lipase (CALB). E espectro (E) das nanoesferas (vermelho) e das nanoestrelas (azul) de ouro, apresentando seus sinais de LSPR em relação ao laser infravermelho (linha tracejada) (imagem: Heloise Ribeiro de Barros/IQ-USP)
Em estudo conduzido no Instituto de Química da USP, pesquisadores aceleram a atividade de enzimas imobilizadas em nanopartículas de ouro por irradiação de laser infravermelho. Técnica pode ter aplicações biomédicas e industriais
Em estudo conduzido no Instituto de Química da USP, pesquisadores aceleram a atividade de enzimas imobilizadas em nanopartículas de ouro por irradiação de laser infravermelho. Técnica pode ter aplicações biomédicas e industriais
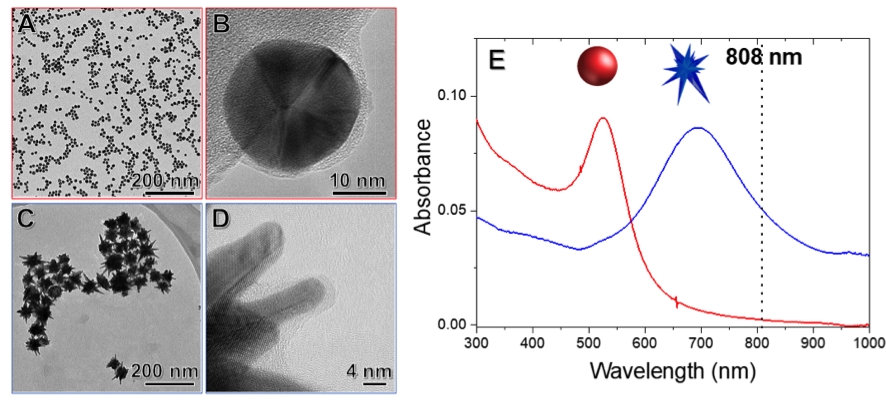
Imagens de microscopia eletrônica de transmissão de nanoesferas (A e B) e de nanoestrelas de ouro (C e D) conjugadas com a lipase (CALB). E espectro (E) das nanoesferas (vermelho) e das nanoestrelas (azul) de ouro, apresentando seus sinais de LSPR em relação ao laser infravermelho (linha tracejada) (imagem: Heloise Ribeiro de Barros/IQ-USP)
José Tadeu Arantes | Agência FAPESP – A atividade das enzimas, tanto em processos industriais e laboratoriais quanto no interior de seres vivos, pode ser controlada remotamente por meio da luz. Para tanto, a enzima deve ser imobilizada nas superfícies de nanopartículas e irradiada com laser. A luz emitida na região do infravermelho é capaz de penetrar tecidos vivos sem danificá-los. As nanopartículas absorvem a energia da radiação e a liberam na forma de calor ou de efeitos eletrônicos, desencadeando ou intensificando a atividade catalítica da enzima. Isso configura um novo campo de estudo denominado biocatálise plasmônica.
Uma pesquisa conduzida no Instituto de Química da Universidade de São Paulo (IQ-USP) investigou a atividade de enzimas imobilizadas em nanopartículas de ouro controladas por irradiação de laser infravermelho. Artigo a respeito foi publicado no periódico ACS Catalysis, da American Chemical Society.
O estudo recebeu apoio da FAPESP por meio de Bolsa de Pós-Doutorado e de Bolsa de Estágio de Pesquisa no Exterior concedidas à autora principal, Heloise Ribeiro de Barros; de Auxílio a Equipamento Multiusuário; e do Projeto Temático “Otimização das propriedades físico-químicas de materiais nanoestruturados e suas aplicações em reconhecimento molecular, catálise e conversão/armazenamento de energia”, coordenado por Roberto Manuel Torresi.
“Utilizamos uma lipase [CALB] como enzima-modelo, imobilizada em nanopartículas de ouro em dois formatos: esferas e estrelas. Por meio do laser infravermelho, foi possível acelerar a atividade da enzima de maneira não invasiva, simplesmente por meio da iluminação com a luz externa”, diz Heloise Ribeiro de Barros à Agência FAPESP.
O estudo mostrou que não apenas a composição do material, mas também sua forma geométrica influenciam o efeito das nanopartículas sobre a enzima. “A atividade enzimática foi aumentada significativamente quando a lipase foi imobilizada em nanoestrelas de ouro, apresentando um aumento de até 58%. Em comparação, as nanoesferas de ouro promoveram um aumento bem menor, de 13%. Esse maior aumento corresponde ao efeito de ressonância entre as superfícies das nanoestrelas e a radiação do laser”, explica Ribeiro de Barros.
A grandeza aqui considerada é chamada de “ressonância plasmônica de superfície localizada” (LSPR, sigla do inglês localized surface plasmon resonances). Enquanto a LSPR das nanoesferas absorve em 525 nanômetros, a das nanoestrelas chega a 700 nanômetros – um valor bem mais próximo do comprimento de onda do laser infravermelho, que é de 808 nanômetros.
“A luz incidente desencadeia processos energéticos, como aumento de temperatura ou efeitos eletrônicos, nas nanopartículas de ouro. E isso afeta as propriedades das enzimas que estão imobilizadas nas superfícies. Foi possível concluir que o aquecimento fototérmico localizado nas superfícies das nanoestrelas de ouro, promovido pela excitação da LSPR, levou ao aumento da biocatálise da lipase. E essa conclusão pode ser estendida a outras combinações de enzimas e nanopartículas plasmônicas”, afirma a pesquisadora.
O espectro de aplicações é amplo. E vai de biocatálise para acelerar reações químicas em escala industrial ao controle, in vivo, de enzimas responsáveis pelo desencadeamento de doenças. Em uma perspectiva futurista, pode-se pensar na utilização desse tipo de processos no tratamento de enfermidades como Parkinson e Alzheimer. Evidentemente, até que isso seja uma alternativa real, mais pesquisa terá que ser feita.
“Do ponto de vista médico, o grande propósito deste estudo é poder proporcionar soluções em um futuro próximo para o tratamento de doenças sem a necessidade de cirurgias invasivas e de uma maneira espaço-temporal específica, para evitar os efeitos colaterais dos métodos atuais”, comenta Ribeiro de Barros.
O artigo Mechanistic insights into the light-driven catalysis of an immobilized lipase on plasmonic nanomaterials pode ser acessado em https://pubs.acs.org/doi/10.1021/acscatal.0c04919.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





