

Concentración de placas seniles en el cerebro de ratones transgénicos que no recibieron estímulos cognitivos (A) y en el de animales expuestos a un ambiente enriquecido (B) (imagen: Frontiers in Aging Neuroscience)
Un estudio realizado en ratones muestra que la estimulación cognitiva y corporal disminuye la acumulación de placas seniles y mejora la memoria espacial
Un estudio realizado en ratones muestra que la estimulación cognitiva y corporal disminuye la acumulación de placas seniles y mejora la memoria espacial
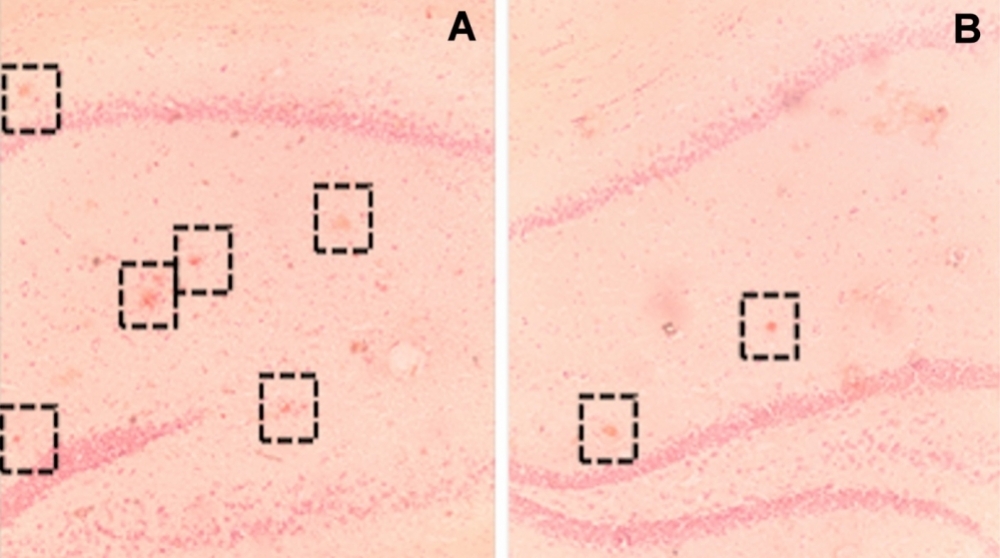
Concentración de placas seniles en el cerebro de ratones transgénicos que no recibieron estímulos cognitivos (A) y en el de animales expuestos a un ambiente enriquecido (B) (imagen: Frontiers in Aging Neuroscience)
Por Elton Alisson | Agência FAPESP – El estímulo a la realización de actividades físicas, sociales y de esparcimiento a ancianos y pacientes con la enfermedad de Alzheimer puede ayudar a preservar las funciones cognitivas y a retrasar las manifestaciones clínicas de la demencia, como la pérdida de la memoria. Esto es lo que apuntan estudios recientes. Sucede que estos estímulos pueden hacer su aporte en la construcción de reservas estructurales y funcionales en el cerebro, protegiéndolo contra las lesiones que ocasionan deterioros cognitivos.
En el marco de un nuevo estudio, que contó con el apoyo de la FAPESP y se realizó en la Universidad de São Paulo (USP) y en la Facultad de Ciencias Médicas del Hospital Santa Casa de São Paulo, en Brasil, se comprobó esta hipótesis.
Los investigadores constataron que la estimulación cognitiva y física de ratones transgénicos envejecidos –en una situación que simula el comienzo tardío del surgimiento de la enfermedad de Alzheimer– protegió el cerebro contra el depósito de placas seniles y generó una mejoría de la memoria espacial de los animales. Los resultados de este trabajo se publicaron en la revista Frontiers in Aging Neuroscience.
“Observamos que la estimulación fue suficiente como para interrumpir la formación de placas seniles y promover una leve mejoría de la memoria espacial de los animales”, declaró Tânia Araújo Viel, docente de la Escuela de Artes, Ciencias y Humanidades de la USP y coordinadora del proyecto, a Agência FAPESP.
Araújo Viel comenta que surgieron diversas evidencias durante los últimos años que apuntan que la enfermedad de Alzheimer se acentúa más en personas que contaron con menos estímulos cognitivos, sociales y físicos durante sus vidas. Estos estímulos promoverían cambios morfológicos y funcionales en el cerebro, que llevarían a la amplificación de las funciones cognitivas.
Con el objetivo de evaluar esta hipótesis, los investigadores analizaron los efectos de la estimulación cognitiva y física sobre la memoria espacial y sobre la formación de placas seniles en ratones transgénicos en fase tardía de sus vidas –con más de ocho meses de edad–, y con elevada expresión de una forma mutante de la proteína precursora del péptido β-amiloide en humanos.
La producción excesiva de este péptido provoca la acumulación de las placas seniles en el cerebro, que es una de las principales características patológicas de la enfermedad de Alzheimer. “Se estima que el aumento de la carga del péptido β-amiloide en el cerebro antecede al comienzo de la enfermedad aproximadamente 20 años”, dijo Araújo Viel.
Los investigadores distribuyeron ratones transgénicos y otro grupo de ratones de tipo silvestre –que no sobreexpresaban la proteína precursora del péptido β-amiloide– en jaulas con distintos tipos de estímulos físicos y cognitivos.
Estos ambientes estaban compuestos por escaleras, ruedas de ejercicios, bolas y objetos de distintos tamaños, colores y texturas que se cambiaban cada dos días. En tanto, otros dos grupos de ratones transgénicos y silvestres quedaron dispuestos en jaulas sin contar con ninguno de esos estímulos.
Los animales fueron mantenidos en esos ambientes entre los 8 y los 12 meses de edad, cuando empiezan a tener las placas seniles características de la enfermedad de Alzheimer. Al cabo de un período de cuatro meses, se los sometió a la evaluación de actividad motora mediante sensores, y de memoria espacial mediante el test denominado Laberinto de Barnes. Con este test se evalúa el tiempo que cada animal tarda para ubicar la salida de un territorio con 30 orificios igualmente espaciados alrededor del borde, de los cuales tan sólo uno lleva a la caja de fuga, tras un período de aprendizaje a los efectos de descubrirlo.
Los resultados de los test mostraron que los ratones transgénicos expuestos al ambiente enriquecido exhibieron una disminución del 24,5% en el tiempo necesario para entrar a la caja de escape una semana después del período de aprendizaje en comparación con los ratones transgénicos que no recibieron estímulos. “Esto sugiere que los primeros experimentaron una ligera mejoría de la memoria espacial”, dijo Araújo Viel.
Al analizar muestras del tejido cerebral de los animales de cada grupo, los investigadores también constataron que los ratones transgénicos expuestos al ambiente enriquecido exhibieron una disminución del 69,2% en la densidad total de placas seniles en comparación con los que no recibieron estímulos.
Asimismo, los primeros exhibieron un pequeño aumento en la densidad de una proteína secuestradora que se ubica en las microglías, que son células inmunitarias del sistema nervioso central. Esta proteína secuestradora ayuda en la degradación del péptido β-amiloide.
La merma en la concentración de placas seniles en el cerebro de los animales fue mayor en la parte dorsal del hipocampo, que está relacionada con la formación de la memoria espacial, aseveraron los investigadores.
“La estimulación de los ratones envejecidos debido a la existencia de un ambiente enriquecido durante cuatro meses llevó a la formación de una reserva cognitiva que protegió el cerebro de los animales contra la acumulación de placas seniles. Y esto promovió una mejoría de la memoria espacial”, dijo Araújo Viel.
En perros y en humanos
A juicio de los científicos, este estudio corrobora que la estimulación cognitiva, social y física puede ser complementaria a los actuales abordajes farmacológicos en el tratamiento de la enfermedad de Alzheimer.
Estos estímulos pueden alterar el metabolismo cerebral, disminuir la neuroinflamación y la reactividad de los astrocitos –las células más abundantes del sistema nervioso central– y proteger al órgano contra la acumulación de péptidos amiloides y contra la formación de placas seniles. Aunque no son inmediatos, los beneficios de estos cambios pueden observarse a largo plazo, sostienen los autores del estudio.
“Este estudio comprueba que los cambios positivos en el estilo de vida pueden fomentar la neuroplasticidad del cerebro y aportar a la construcción de una reserva cognitiva durante el envejecimiento, por ejemplo”, dijo Araújo Viel.
Araújo Viel está realizando actualmente una pasantía de investigación en el Buck Institute for Research on Aging de California, en Estados Unidos, con una beca de la FAPESP.
Durante la pasantía, la investigador ha venido estudiando la acción del litio aplicado en microdosis en astrocitos humanos derivados de células madre pluripotentes inducidas (iPSCs, del inglés induced pluripotent sten cells), una tecnología en ascenso, con potencial como para promover la denominada “medicina individualizada”, de manera tal de perfeccionar los efectos terapéuticos y disminuir los efectos colaterales.
“La alteración del estilo de vida también comprende la utilización de nutracéuticos [alimentos que además nutrir, pueden generar otros efectos beneficiosos para la salud] para la construcción de la reserva cognitiva, que es un efecto similar al que se observa con el enriquecimiento ambiental”, dijo.
Los investigadores también han realizado estudios comparativos con muestras de sangre de perros jóvenes y ancianos para evaluar si existen diferencias en biomarcadores cerebrales, también detectados en la sangre en esos animales.
El próximo experimento que pretenden llevar adelante consistirá en evaluar si el ambiente enriquecido también altera los marcadores sanguíneos relacionados con la memoria de esos animales y con la de seres humanos. De este modo pretenden verificar si las diferencias en los biomarcadores cerebrales y sanguíneos que observaron en ratones también se encuentran presentes en perros y en humanos.
“Contamos ya con algunas evidencias que indican que sí, pero estamos efectuando ahora una especie de barrido de diversos marcadores biológicos para comprobarlas” dijo Araújo Viel.
La elección del perro doméstico como modelo para este tipo de estudios se debe al hecho de que este animal tiende a tener un estilo de vida muy parecido al de su dueño. Si el dueño es activo físicamente, el animal tiende también a ser más activo, según apuntan estudios recientes.
“Pretendemos analizar si existe una diferencia entre los biomarcadores cognitivos de estos animales con otros que permanecen más dentro de sus casas o departamentos, por ejemplo”, afirmó.
Puede leerse el artículo intitulado Enriched environment significantly reduced senile plaques in a transgenic mice model of Alzheimer’s disease, improving memory (doi: 10.3389/fnagi.2018.00288), de Janaina Balthazar, Natalia Mendes Schöwe, Gabriela Cabett Cipolli, Hudson Sousa Buck y Tania Araújo Viel, en la revista Frontiers in Aging Neuroscience, en el siguiente enlace: www.frontiersin.org/articles/10.3389/fnagi.2018.00288/full.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





