
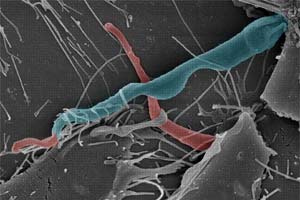
Estudo realizado por pesquisadores brasileiros demonstra que Trypanosoma cruzi utiliza o próprio mecanismo de reparo da membrana da célula hospedeira para invadi-la (Foto: Renato Mortara)
Estudo realizado por pesquisadores brasileiros demonstra que Trypanosoma cruzi utiliza o próprio mecanismo de reparo da membrana da célula hospedeira para invadi-la
Estudo realizado por pesquisadores brasileiros demonstra que Trypanosoma cruzi utiliza o próprio mecanismo de reparo da membrana da célula hospedeira para invadi-la

Estudo realizado por pesquisadores brasileiros demonstra que Trypanosoma cruzi utiliza o próprio mecanismo de reparo da membrana da célula hospedeira para invadi-la (Foto: Renato Mortara)
Por Fábio de Castro
Agência FAPESP – Vários patógenos empregam uma estratégia traiçoeira para invadir uma célula hospedeira: eles subvertem mecanismos existentes na própria membrana celular para ter acesso ao citoplasma.
Um grupo de pesquisadores brasileiros acaba de demonstrar que o Trypanosoma cruzi, causador da doença de Chagas, utiliza esse tipo de subterfúgio, aproveitando o mecanismo de reparo das membranas das células como recurso para invadi-las.
O estudo, publicado na revista Journal of Experimental Medicine, teve origem em linhas de pesquisa desenvolvidas por Norma Andrews, do Departamento de Biologia Celular e Genética Molecular da Universidade de Maryland (Estados Unidos), e Renato Mortara, do Departamento de Microbiologia, Imunologia e Parasitologia da Universidade Federal de São Paulo (Unifesp).
O trabalho mereceu destaque em editoriais das revistas Cell e Nature Reviews in Microbiology. A primeira autora do artigo, Maria Cecília Fernandes, concluiu seu doutorado em 2007, com Bolsa da FAPESP, no laboratório de Mortara na Unifesp e preparou o trabalho durante seu pós-doutorado no laboratório de Andrews, nos Estados Unidos. Os outros autores do artigo são Mauro Cortez, Andrew Flannery e Christina Tam, todos da Universidade de Maryland.
Andrews tem trabalhado com a interação entre o Trypanosoma cruzi e células hospedeiras pelo menos desde seu doutorado – realizado no Departamento de Bioquímica da Universidade de São Paulo (USP), também com Bolsa da FAPESP, com orientação de Walter Colli.
A pesquisadora brasileira radicada nos Estados Unidos fez seu pós-doutorado com Victor Nussenzweig, na Universidade de Nova York, e foi professora e pesquisadora na Universidade de Yale, antes de se transferir para a Universidade de Maryland.
Mortara realizou estágio no laboratório de Andrews, com apoio da FAPESP, por meio do Projeto Temático Estudos moleculares do Trypanosoma cruzi e de sua interação com células e fatores do hospedeiro in vitro e in vivo, coordenado por José Franco da Silveira Filho, também da Unifesp.
Enquanto Mortara desenvolve estudos sobre a invasão celular pelo parasita, Andrews tem dado atenção especial aos estudos sobre o reparo da membrana plasmática de células eucarióticas. Segundo Mortara, Fernandes conseguiu, em seu trabalho, demonstrar o encontro dessas duas importantes vias biológicas: a invasão celular pelo parasita e o reparo de membrana.
“O artigo teve grande repercussão porque demonstrou que o Trypanosoma cruzi é mais um microrganismo capaz de explorar um mecanismo constitutivo da célula hospedeira, além de descrever detalhadamente o mecanismo que o parasita utiliza para isso”, disse Mortara à Agência FAPESP.
O laboratório de Andrews já havia desenvolvido estudos sobre as funções dos lisossomos – organelas celulares responsáveis por degradar partículas provenientes do meio extracelular – no reparo de membranas. Segundo Mortara, já se sabia que, quando a membrana da célula sofre um dano, os lisossomos são recrutados e liberam seu conteúdo, que se funde com a membrana, reparando a lesão.
“O grupo de Maryland observou recentemente que esse mecanismo de reparo tem duas etapas. Quando o lisossomo se funde com a membrana, a célula continua ainda com uma ruptura. Então, uma parte da membrana é internalizada pela célula, incorporando a lesão. A ruptura é englobada por essa espécie de ‘bolha’, passando para o interior da célula, preservando as propriedades da membrana”, explicou.
Fernandes juntou o conhecimento sobre a invasão do parasita e o reparo da membrana. A pesquisadora observou que o parasita provoca danos na membrana, induzindo todo o processo de internalização da lesão. “Como o parasita permanece próximo à lesão, o processo acaba levando-o para o interior da célula”, contou Mortara.
Quando o parasita danifica a membrana, o dano não promove diretamente sua entrada no citoplasma. Mas desencadeia a mobilização dos lisossomos, que, além de liberar seu conteúdo para a superfície da célula, liberam também a enzima lisossomal esfingomielinase ácida (ASMase), dependente de cálcio.
“O estudo mostrou que as células com ASM reduzida são resistentes à infecção e que tratar as células com enzimas extracelulares é suficiente para promover a entrada do parasita. O aumento de ASM estimula a endocitose, dando ao parasita a chance para entrar na célula”, explicou.
Segundo o estudo, o uso do mecanismo de reparo da membrana pelo Trypanosoma cruzi pode ajudar a explicar por que esses parasitas tendem a infectar músculos lisos e cardiomiócitos – tecidos nos quais os mecanismos de reparo são especialmente ativos.
O artigo Trypanosoma cruzi subverts the sphingomyelinase-mediated plasma membrane repair pathway for cell invasion (doi:10.1084/jem.20102518), de Maria Cecília Fernandes e outros, pode ser lido por assinantes da Journal of Experimental Medicine em jem.rupress.org/content/early/2011/04/27/jem.20102518.abstract.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





