

Esquema do desenvolvimento do Bioprocesso de produção da FVIII em células humanas (imagem: Virgínia Picanço Castro))
Produção do fator VIII recombinante foi desenvolvida pelo Centro de Terapia Celular, um dos CEPIDs apoiados pela FAPESP
Produção do fator VIII recombinante foi desenvolvida pelo Centro de Terapia Celular, um dos CEPIDs apoiados pela FAPESP
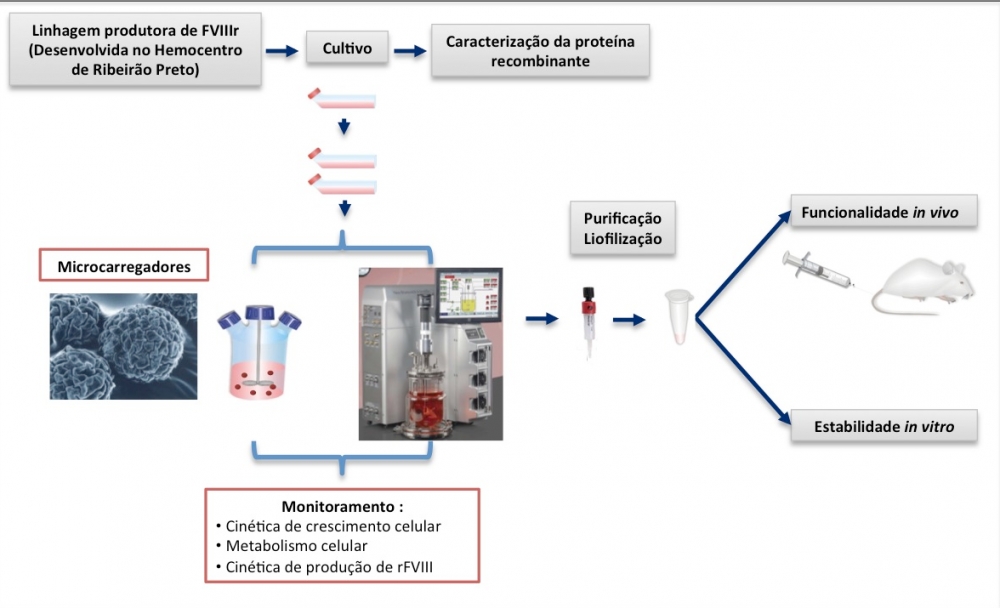
Esquema do desenvolvimento do Bioprocesso de produção da FVIII em células humanas (imagem: Virgínia Picanço Castro))
Agência FAPESP – A Fundação Hemocentro de Ribeirão Preto da Universidade de São Paulo obteve a patente de produção do fator VIII recombinante, concedida pelo governo dos Estados Unidos. A plataforma desenvolvida pelos pesquisadores do Centro de Terapia Celular da USP (CTC-USP) – um dos Centros de Pesquisa, Difusão e Inovação (CEPIDs) apoiados pela FAPESP – permite a fabricação de um produto mais seguro, livre de potenciais viroses humanas, com custo reduzido e mais estável.
A plataforma está registrada no United States Patent and Trademark Office (USPTO) sob o número US 8,969,041 B2, com validade até 19 de janeiro de 2032.
O fator VIII de coagulação é essencial aos cerca de 9 mil brasileiros portadores de hemofilia A. A tecnologia é totalmente nacional e pode produzir quantidades suficientes e em escala industrial que atendam à demanda do país.
A patente apresenta algumas vantagens em relação aos fatores de engenharia genética, já existentes no mercado, e ao plasma humano. O agente é produzido por vetor que se integra no DNA da célula produtora, apresentando maior estabilidade e durabilidade.
O novo fator VIII é produzido em células humanas, enquanto os produtos comerciais são produzidos em células murinas (células de camundongos), que gera uma proteína com pequenas diferenças em relação à encontrada no plasma.
No fator VIII recombinante desenvolvido pelos pesquisadores do CTC-USP, a produção é realizada em células humanas, as quais são capazes de produzir uma proteína idêntica à do plasma humano. “O resultado é uma melhor eficácia do produto e menos efeitos colaterais, como formação de anticorpos contra a proteína recombinante”, explica Virginia Picanço Castro, uma das pesquisadoras responsáveis pela plataforma.
O uso do fator VIII recombinante para o tratamento da hemofilia A no Brasil foi aprovado pelo Ministério da Saúde (MS) em março de 2013. Até então, segundo o MS, tinham sido gastos R$ 522 milhões na importação de fatores VIII nos anos de 2011, 2012 e no primeiro trimestre de 2013.
O Centro de Terapia Celular, coordenado por Dimas Tadeu Covas, desenvolve pesquisas relacionadas à produção de fator FVIII e FIX de coagulação utilizando células humanas.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





