

Pesquisadores do Redoxoma mostraram que moléculas capazes de livrar as células da substância oxidante conhecida como peróxido de hidrogênio podem ser encontradas em diferentes partes da mitocôndria (imagem) (arte sobre imagem Wikimedia Commons/Jornal da USP)
Pesquisadores do Redoxoma mostraram que moléculas capazes de livrar as células da substância oxidante conhecida como peróxido de hidrogênio podem ser encontradas em diferentes partes da mitocôndria
Pesquisadores do Redoxoma mostraram que moléculas capazes de livrar as células da substância oxidante conhecida como peróxido de hidrogênio podem ser encontradas em diferentes partes da mitocôndria
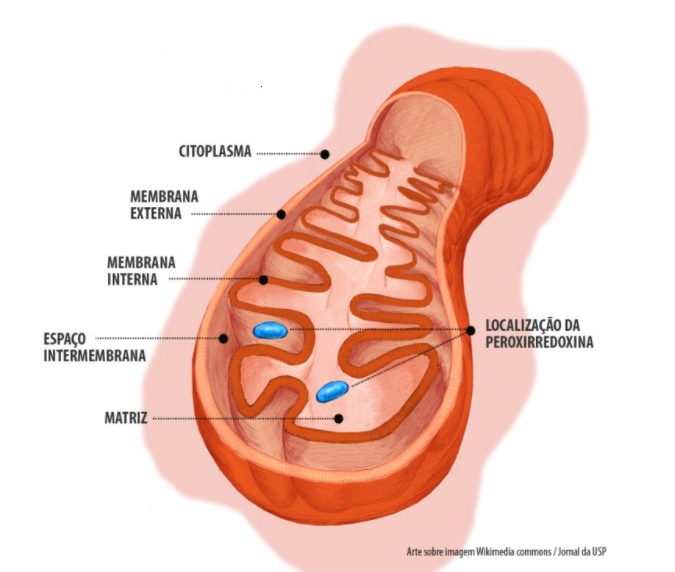
Pesquisadores do Redoxoma mostraram que moléculas capazes de livrar as células da substância oxidante conhecida como peróxido de hidrogênio podem ser encontradas em diferentes partes da mitocôndria (imagem) (arte sobre imagem Wikimedia Commons/Jornal da USP)
Karina Toledo | Agência FAPESP – A respiração celular, processo que ocorre dentro de uma organela conhecida como mitocôndria e que garante energia para o funcionamento dos organismos, pode eventualmente gerar subprodutos que são tóxicos para as células: as chamadas espécies reativas de oxigênio (ROS, na sigla em inglês).
Em excesso, essas substâncias oxidantes interagem com proteínas, lipídios, carboidratos e ácidos nucleicos fazendo com que as macromoléculas percam sua função. Tal processo pode levar à morte celular e, nos seres mais complexos como os humanos, contribuir para a indução de doenças como câncer, artrite, aterosclerose, Parkinson e Alzheimer.
Estudos mais recentes, no entanto, têm mostrado que, em quantidades adequadas, moléculas reativas como o peróxido de hidrogênio podem atuar como agentes sinalizadores em importantes processos celulares, contribuindo para o bom funcionamento do organismo. Às enzimas antioxidantes cabe a missão de manter as espécies reativas em níveis aceitáveis, protegendo as células do dano oxidativo.
“A peroxirredoxina é a principal enzima responsável por remover o peróxido de hidrogênio de dentro da mitocôndria. Já se sabia, portanto, que ela estava presente nessa organela, mas o local exato não era conhecido. Nosso grupo mostrou que a proteína pode ser encontrada em dois subcompartimentos mitocondriais e isso nos dá pistas sobre os papéis que ela exerce na organela”, contou Luis Eduardo Soares Netto, professor do Instituto de Biociências da Universidade de São Paulo (IB-USP).
A investigação foi conduzida durante o doutorado de Fernando Gomes, sob a orientação de Netto, e contou com a colaboração de Mario Barros, professor do Instituto de Ciências Biomédicas (ICB-USP) e especialista em biogênese mitocondrial. O grupo está vinculado ao Centro de Pesquisa em Processos Redox em Biomedicina (Redoxoma), um Centro de Pesquisa, Inovação e Difusão (CEPID) da FAPESP.
Além de mapear a localização das peroxirredoxinas na mitocôndria, os pesquisadores também identificaram as proteínas responsáveis por fazer o transporte dessa enzima do citoplasma celular, onde ela é produzida, até os subcompartimentos mitocondriais, onde ela deve atuar. Como modelo, o grupo usou células da espécie Saccharomyces cerevisiae – a levedura do pão e da cerveja.
Os resultados do estudo foram publicados no Journal of Biological Chemistry – JBC.
“A mitocôndria tem quatro subcompartimentos: a matriz, que é a parte maior e mais central, onde fica o DNA mitocondrial e onde ocorre o ciclo de Krebs [importante etapa da respiração celular aeróbica]; a membrana interna, onde é produzido o ATP [adenosina trifosfato, molécula que armazena energia]; a membrana externa, que separa a mitocôndria do resto da célula; e o espaço intermembranas”, explicou Netto.
Segundo o pesquisador, cada subcompartimento costuma ter um conjunto específico de proteínas. A peroxirredoxina é um dos poucos casos em que a mesma proteína pode ser encontrada ao mesmo tempo em mais de um local dentro da organela: a matriz mitocondrial e o espaço intermembranas.
“Uma hipótese plausível é que na matriz ela tenha o papel de proteger o DNA mitocondrial do dano oxidativo, dentro de uma visão mais clássica do papel das enzimas antioxidantes. Já no espaço intermembrana é possível que ela tenha uma função regulatória e participe do processo de formação de pontes dissulfeto entre proteínas”, disse Netto.
Esse tipo de ligação química, que ocorre entre dois aminoácidos do tipo cisteína, confere uma maior estabilidade para as proteínas e, em alguns casos, pode ser essencial para que a molécula exerça suas funções adequadamente.
“Para que ocorra a formação da ponte dissulfeto, a proteína-alvo precisa ser oxidada e a peroxirredoxina poderia estar regulando esse processo de transferência de elétrons dentro do espaço intermembranas. Mas é algo que ainda precisa ser melhor investigado”, disse Netto.
Um dos projetos futuros do grupo, contou o pesquisador, é desenvolver uma levedura modificada, que expresse apenas a isoforma da peroxirredoxina presente na matriz ou apenas a isoforma encontrada no espaço intermembranas. “Desse modo, poderíamos analisar individualmente cada uma das funções dessa enzima dentro da mitocôndria.”
Mecanismo conservado
Ao estudar a organela de leveduras, a equipe do Redoxoma observou que, inicialmente, a peroxirredoxina é transportada do citoplasma celular para o interior mitocondrial por uma proteína chamada TOM. Quando ela chega à membrana interna, a proteína TIM23 assume a função de levá-la até a matriz mitocondrial. Nesse subcompartimento, a enzima é processada por duas proteases (enzimas que quebram ligações peptídicas de outras proteínas) conhecidas como MPP e Oct1, que cortam pedaços da molécula fazendo com que ela permaneça naquele local.
Em alguns casos, porém, antes que a TIM23 consiga levar a peroxirredoxina até a matriz, outras duas proteases encontradas na membrana interna – Imp1 e Imp2 – processam a enzima, fazendo com que ela permaneça no meio do caminho, sendo em seguida liberada no espaço intermembranas.
“São dois eventos que ocorrem de maneira alternativa. Sabemos que o ponto em que é determinado se a peroxirredoxina vai para a matriz ou fica no espaço intermembranas é quando ela interage com TIM23. Mas ainda não sabemos ao certo em que contexto isso acontece”, disse Netto.
Em um dos experimentos, o grupo do IB-USP modificou geneticamente a levedura para fazê-la expressar a peroxirredoxina humana. Desse modo, foi possível verificar que a enzima é reconhecida pelas mesmas proteínas transportadoras e todo o processo ocorre de maneira similar ao observado na levedura “selvagem” (não modificada).
“O fato de o transporte da peroxirredoxina para a mitocôndria ser um processo conservado ao longo da evolução sugere que este deve ser um evento importante, crucial para o funcionamento da organela”, avaliou Netto.
E como qualquer evento que afete a função mitocondrial pode comprometer a sobrevivência da célula, ponderou o pesquisador, é possível que a peroxirredoxina ou que algumas das moléculas que fazem seu transporte para o interior da mitocôndria possam ser alvos para o tratamento de doenças neurodegenerativas, câncer, diabetes e muitas outras.
O artigo Proteolytic cleavage by the IMP complex or Oct1 peptidase controls the localization of the yeast peroxiredoxin Prx1 to distinct mitochondrial compartments (doi: 10.1074/jbc.M117.788588) pode ser lido em: http://www.jbc.org/content/early/2017/08/18/jbc.M117.788588.short.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





