

Pesquisa divulgada na capa da revista Science Signaling explica como ocorre a interação de uma reação química conhecida como fosforilação, catalisada por enzimas quinases (imagem: Deborah Schechtman)
Pesquisa divulgada na capa da revista Science Signaling explica como ocorre a interação de uma reação química conhecida como fosforilação, catalisada por enzimas quinases
Pesquisa divulgada na capa da revista Science Signaling explica como ocorre a interação de uma reação química conhecida como fosforilação, catalisada por enzimas quinases
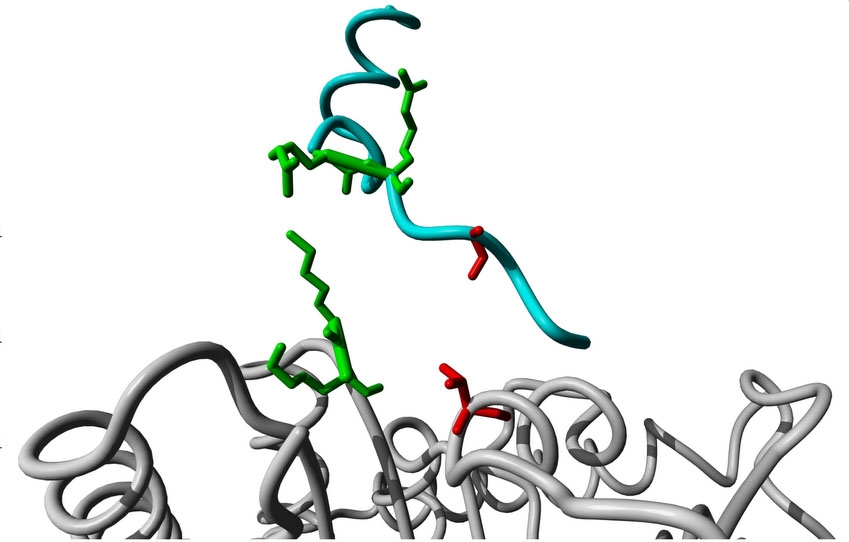
Pesquisa divulgada na capa da revista Science Signaling explica como ocorre a interação de uma reação química conhecida como fosforilação, catalisada por enzimas quinases (imagem: Deborah Schechtman)
Por Karina Toledo
Agência FAPESP – As quinases são enzimas que funcionam como uma espécie de “chave liga e desliga” de proteínas e, dessa forma, regulam processos importantes no organismo, entre eles divisão, proliferação e diferenciação celular.
Qualquer problema nessa sinalização pode resultar em patologias como câncer, inflamação ou doenças cardiovasculares. Por esse motivo, cerca de 25% dos esforços da indústria farmacêutica visam a desenvolver compostos capazes de modular a atividade dessas enzimas.
Um estudo conduzido por pesquisadores brasileiros que foi destaque de capa da revista Science Signaling pode tornar mais fácil identificar a proteína-alvo (ou substrato) de uma determinada quinase – tarefa nada trivial, considerando que no genoma humano existem mais de 500 diferentes enzimas do tipo.
“Quando conseguimos identificar o substrato de uma quinase podemos não apenas compreender melhor sua função no organismo como também desenhar compostos capazes de modular sua ação de forma mais seletiva, causando menos efeitos adversos”, afirmou Deborah Schechtman, professora do Instituto de Química da Universidade de São Paulo (USP) e coordenadora da pesquisa apoiada pela FAPESP.
As quinases, explicou Schechtman, são responsáveis por uma reação química conhecida como fosforilação, que consiste em transferir um grupo fosfato de moléculas de alta energia, como o ATP (adenosina trifosfato), para a proteína-alvo. Essa reação pode fazer, dependendo do caso, com que a proteína seja ativada, desativada ou, ainda, sinalizar para que a molécula seja degradada.
Mas, para que ocorra a interação, enzima e substrato precisam se encaixar como peças de um quebra-cabeça. A proteína-alvo deve ter uma sequência específica de aminoácidos – tecnicamente chamada “sequência consenso” – capaz de ser reconhecida pela quinase.
“As pesquisas anteriores buscavam essa sequência consenso na estrutura linear da proteína [na cadeia de aminoácidos ligados quimicamente entre si]. Nosso trabalho mostrou que, em alguns casos, só é possível encontrá-la quando se olha para a estrutura tridimensional da molécula. É uma mudança de paradigma”, afirmou Schechtman.
Para que a proteína possa desempenhar sua função dentro da célula, a cadeia de aminoácidos que a compõe precisa se dobrar e assumir uma forma tridimensional específica – processo conhecido como enovelamento.
Quando isso acontece, aminoácidos que estavam distantes uns dos outros na estrutura primária passam a ficar próximos e – em alguns casos – podem formar o que o grupo de Schechtman chamou de consenso estrutural, que também pode ser reconhecido pela quinase.
“Nós confirmamos que os chamados resíduos âncoras – que formam o consenso que será reconhecido pela quinase – são importantes para que ocorra a interação entre enzima e substrato e podem ser alvos para o desenvolvimento de drogas inibidoras com atividade altamente específica”, afirmou Schechtman.
De acordo com a pesquisadora, os inibidores hoje disponíveis no arsenal farmacêutico impedem a transferência do grupo fosfato para as proteínas, mas afetam as quinases do organismo de maneira indiscriminada, podendo prejudicar processos fisiológicos.
Tubulina
A linha de investigação que levou à descoberta publicada na Science Signaling teve início em um projeto anterior, também apoiado pela FAPESP, no qual Schechtman tentava descobrir substratos de uma quinase conhecida como PKC (proteína quinase C), envolvida na proliferação e diferenciação de células-tronco embrionárias.
“Descobri que a PKC interagia com uma proteína chamada tubulina, que participa do processo de divisão celular. Fomos então investigar esse substrato. Por uma técnica conhecida como espectrometria de massa, identificamos com qual resíduo de aminoácido da tubulina a PKC interagia e percebemos que não havia em torno dele uma sequência consenso de reconhecimento da quinase”, contou a pesquisadora.
Em parceria com o grupo do pesquisador Paulo Sergio Lopes de Oliveira, do Laboratório Nacional de Biociências (LNBio), Schechtman decidiu investigar a estrutura tridimensional da tubulina e encontrou o que chamou de consenso estrutural.
“Para confirmar, produzimos algumas versões mutadas da tubulina, com resíduos âncoras diferentes, e vimos que o reconhecimento pela quinase ficava bastante prejudicado”, contou Schechtman.
O passo seguinte foi provar que o consenso estrutural também poderia ser encontrado em outras proteínas e, para isso, os pesquisadores realizaram um trabalho de modelagem.
“Como se tratava de provar um conceito e há poucos substratos conhecidos para a PKC, fizemos esse trabalho de modelagem com a PKA (proteína quinase A), outra quinase mais bem estudada. Dessa forma, nossa amostragem seria maior”, contou Oliveira.
Os pesquisadores então analisaram um banco de dados de sítios de fosforilação da PKA detectados experimentalmente, compararam com informações de um banco de estruturas tridimensionais de proteínas determinadas por cristalografia e recorreram à modelagem para ver como as sequências ficariam no espaço em três dimensões.
“Modelamos mais de mil substratos de PKA e vimos que, em 27 casos, os resíduos âncoras apresentavam apenas o consenso estrutural”, contou Oliveira.
Os resultados da modelagem também sugerem que, para que a proteína seja reconhecida pela quinase, não apenas a ordem dos aminoácidos na estrutura deve ser a correta como também a distância entre eles é um fator determinante. Como peças de um quebra-cabeça.
Atualmente, o grupo de Schechtman continua a investigar a proteína tubulina na tentativa de entender qual é o efeito da fosforilação que ocorre durante a divisão celular. O objetivo da pesquisadora é compreender melhor os processos moleculares de diferenciação das células-tronco embrionárias, algo essencial para que elas possam ser usadas com mais segurança na terapia celular.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





