

Grupo do Centro de Pesquisa em Processos Redox em Biomedicina da USP descreve pela primeira vez a reprogramação metabólica e outras alterações cardíacas que surgem no contexto da doença renal policística autossômica dominante. Resultados possibilitam a busca de intervenções terapêuticas (imagem: Redoxoma/divulgação)
Grupo do Centro de Pesquisa em Processos Redox em Biomedicina da USP descreve pela primeira vez a reprogramação metabólica e outras alterações cardíacas que surgem no contexto da doença renal policística autossômica dominante. Resultados possibilitam a busca de intervenções terapêuticas
Grupo do Centro de Pesquisa em Processos Redox em Biomedicina da USP descreve pela primeira vez a reprogramação metabólica e outras alterações cardíacas que surgem no contexto da doença renal policística autossômica dominante. Resultados possibilitam a busca de intervenções terapêuticas
Grupo do Centro de Pesquisa em Processos Redox em Biomedicina da USP descreve pela primeira vez a reprogramação metabólica e outras alterações cardíacas que surgem no contexto da doença renal policística autossômica dominante. Resultados possibilitam a busca de intervenções terapêuticas (imagem: Redoxoma/divulgação)
Agência FAPESP* – Estudo conduzido no Centro de Pesquisa em Processos Redox em Biomedicina (Redoxoma) da Universidade de São Paulo (USP) ajuda a entender como uma condição hereditária que afeta os rins – a doença renal policística autossômica dominante (DRPAD) – pode levar ao desenvolvimento de disfunção cardíaca, hoje considerada a principal causa de morte nesses pacientes.
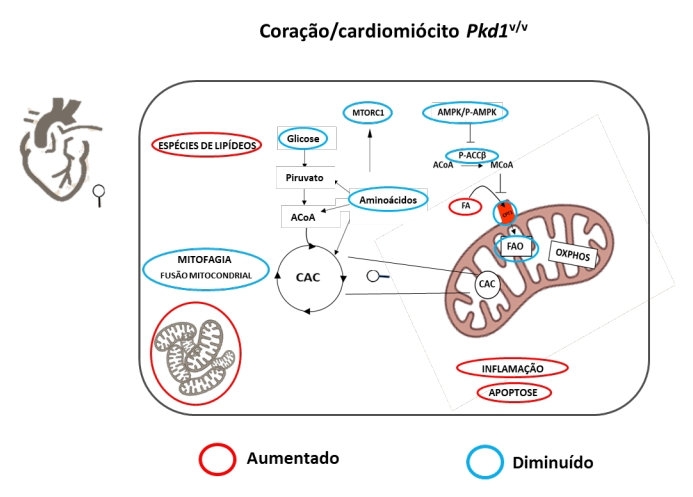
Em artigo publicado na revista Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease, os cientistas descreveram pela primeira vez a reprogramação metabólica que ocorre no coração e as anormalidades mitocondriais (que afetam a organela celular responsável pela produção de energia) que surgem no contexto da DRPAD. Embora o estudo tenha sido feito em um modelo animal, várias das alterações observadas podem potencialmente ser aplicáveis à doença humana.
Como explicam os autores, a DRPAD é uma enfermidade sistêmica que leva à formação de cistos renais múltiplos e bilaterais e à perda progressiva da função renal, além de apresentar manifestações extrarrenais, como alterações cardiovasculares. Segundo estimativas, a doença acomete uma em cada mil pessoas. Na grande maioria dos casos, é causada por mutações no gene Pkd1, que codifica a proteína policistina-1, ou no gene Pkd2, que codifica a policistina-2. Nas últimas décadas, muitos estudos foram direcionados ao entendimento dos mecanismos moleculares envolvidos na formação dos cistos renais no contexto da DRPAD. E os defeitos metabólicos ganharam destaque nos últimos anos. No entanto, os mecanismos moleculares envolvidos na disfunção cardíaca associada à DRPAD ainda são desconhecidos.
“Este trabalho pioneiro propõe que alterações metabólicas estão envolvidas na disfunção cardíaca associada à deficiência funcional de policistina-1, revelando aspectos comuns e diferentes dos descritos para rins císticos de modelos animais no gene ortólogo ao Pkd1 [o gene correspondente no modelo animal]. É um estudo inicial, que abre a possibilidade de propor intervenções terapêuticas. Antigamente, pessoas com essa doença morriam de insuficiência renal, mas agora, com diálise e transplante renal, a maior parte das mortes é por alterações cardiovasculares”, conta Andressa Godoy Amaral, primeira autora do artigo.
Amaral realizou a pesquisa durante seu doutorado, sob a supervisão do professor Luiz Fernando Onuchic, responsável pelo Laboratório de Nefrologia Celular, Genética e Molecular da Faculdade de Medicina da USP.
O trabalho contou com a colaboração das pesquisadoras Alicia Kowaltowski e Sayuri Miyamoto, ambas do Instituto de Química da USP e do Redoxoma, um Centro de Pesquisa, Inovação e Difusão (CEPID) da FAPESP. Estudos de metabolômica foram realizados no Laboratório Nacional de Biociências (LNBio), em Campinas.
O grupo de Miyamoto foi responsável pela análise lipidômica (do perfil de lipídios) do tecido cardíaco. Os dados obtidos, segundo a pesquisadora, serviram para demonstrar o extenso remodelamento lipídico que ocorre no coração. Também serviram como base para a geração de hipóteses sobre as vias de metabolismo lipídico desreguladas.
Reprogramação metabólica
O coração é um órgão metabolicamente muito ativo, no qual as mitocôndrias respondem por 25% a 30% do volume dos cardiomiócitos, as células musculares cardíacas, explica Amaral. E a maior parte da energia usada pelo coração vem da oxidação de ácidos graxos, ou seja, o coração usa principalmente gordura para obter energia. Mas isso só acontece após o nascimento, quando a disponibilidade de oxigênio é maior. O coração fetal usa predominantemente a glicose como substrato para a produção de ATP (trifosfato de adenosina, a molécula usada como combustível pelas células).
“Uma característica comum a várias disfunções cardíacas é essa ‘desdiferenciação’ para o fenótipo fetal. Ou seja, o coração volta a preferir substratos alternativos em vez do ácido graxo. E nós vimos exatamente isso neste trabalho, uma reprogramação metabólica do coração”, conta Amaral.
Para analisar o impacto da policistina-1 no metabolismo cardíaco, os pesquisadores usaram camundongos denominados Pkd1V/V, que são incapazes de clivar (quebrar) essa proteína no sítio GPS e apresentam rins intensamente císticos e disfunção cardíaca precoce. “Essa proteína é grande e complexa e depende de uma clivagem no sítio GPS para amadurecer e migrar para os locais onde ela vai atuar”, explicou Amaral.
O estudo mostrou que os corações Pkd1V/V apresentaram níveis mais baixos de glicose e de aminoácidos, bem como níveis mais elevados de lipídios do que os órgãos de animais do grupo controle. Essa observação sugeriu diminuição da beta-oxidação de ácidos graxos em corações Pkd1V/V, o que foi confirmado pelo menor consumo de oxigênio pelas mitocôndrias na presença de ácido graxo. Além disso, apresentavam maior densidade de mitocôndrias de tamanho reduzido e aumento de apoptose (morte celular programada) e inflamação. Contudo, os corações desses animais não estavam hipertrofiados.
Foram analisados tecidos e mitocôndrias do coração de animais com 15 dias de vida, idade em que camundongos Pkd1V/V apresentam tanto disfunção cardíaca quanto cistos renais. De forma complementar, algumas análises foram realizadas em cardiomiócitos isolados de neonatos (0 a 3 dias de vida), idade em que não há a presença de cistos renais, para avaliar alterações cardíacas certamente independentes do fenótipo renal. As comparações foram feitas entre animais Pkd1V/V e controles selvagens e confirmaram reordenamento metabólico.
Segundo os autores do artigo, esse estudo liga a clivagem da policistina-1 ao desenvolvimento do coração e à manutenção da homeostase metabólica cardíaca. Pode ser considerado, portanto, um marco conceitual na elucidação da patogênese da disfunção cardíaca associada à deficiência funcional dessa proteína.
O artigo Disruption of polycystin-1 cleavage leads to cardiac metabolic rewiring in mice pode ser lido em: www.sciencedirect.com/science/article/abs/pii/S0925443922000345?via%3Dihub.
* Com informações da Assessoria de Comunicação do Redoxoma .
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





