

Representação esquemática do efeito de agregação ou do ambiente celular sobre a estrutura e a atividade da enzima TCPTP (figura: May Thwe Tun et al./Journal of Biological Chemistry)
Pesquisadores da USP e colaboradores conseguiram reproduzir em laboratório o comportamento da enzima PTPN2, um tipo de fosfatase que costuma estar disfuncional em pessoas com artrite reumatoide, esclerose sistêmica, diabetes tipo 1 e lúpus. Resultado abre caminho para a busca de fármacos
Pesquisadores da USP e colaboradores conseguiram reproduzir em laboratório o comportamento da enzima PTPN2, um tipo de fosfatase que costuma estar disfuncional em pessoas com artrite reumatoide, esclerose sistêmica, diabetes tipo 1 e lúpus. Resultado abre caminho para a busca de fármacos
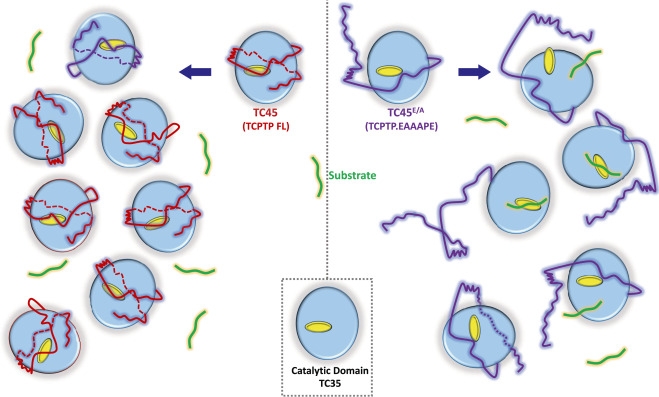
Representação esquemática do efeito de agregação ou do ambiente celular sobre a estrutura e a atividade da enzima TCPTP (figura: May Thwe Tun et al./Journal of Biological Chemistry)
Julia Moióli | Agência FAPESP – Envolvidas em uma série de processos biológicos, as enzimas fosfatases têm relação direta com diversas doenças. Uma proteína dessa classe, conhecida como PTPN2 (sigla em inglês para proteína tirosina fosfatase tipo 2 não receptora), é muito expressa em células T (linfócitos) do sistema imunológico (por isso, também é conhecida como proteína tirosina fosfatase de células T ou, simplesmente, TCPTP) e sua deficiência estimula respostas inflamatórias como as que ocorrem nos casos de diabetes tipo 1, artrite reumatoide, osteoartrite, lúpus e certos tipos de cânceres. Entender seu mecanismo molecular em laboratório, no entanto, era uma tarefa complexa, uma vez que seu comportamento era distinto no organismo.
Pesquisadores das universidades de São Paulo e da Califórnia em San Diego (Estados Unidos) conseguiram reproduzir em laboratório a performance in vivo da enzima e entender seu funcionamento, abrindo portas para a investigação de drogas que tenham eficácia sobre ela. Os resultados do estudo foram publicados no Journal of Biological Chemistry.
Apoiada pela FAPESP, a investigação teve início com uma extensa busca na literatura científica para que os autores pudessem pensar em estratégias a serem aplicadas nos ensaios in vitro a fim de mimetizar o ambiente intracelular. Isso foi alcançado após inúmeros ensaios experimentais sem sucesso.
“Descobrimos que, no interior de diferentes células humanas, a PTPN2 se agrega naturalmente, reduzindo sua ação enzimática e, então, em laboratório, lançamos mão de drogas denominadas crowding agents, que promovem essa agregação sem afetar a atividade da enzima”, explica Fábio Luis Forti, professor do Departamento de Bioquímica do Instituto de Química da USP (IQ-USP) e coautor do estudo.
Os pesquisadores acreditam que esse fator possa explicar por que uma enzima tão relevante ainda seja pouco entendida em nível molecular in vivo, apesar de muito investigada. A partir de agora, acreditam, novos estudos devem surgir. “Conseguimos reproduzir os mesmos resultados da atividade da PTPN2, inclusive em alvos que estão envolvidos diretamente nas respostas imunológicas.”
A enzima atua diretamente, por exemplo, na via de sinalização de JAK-STAT, a principal envolvida na expressão gênica voltada a respostas imunes. “Qualquer mecanismo químico, físico ou biológico que dispare uma resposta imune nas nossas células é normalmente mediado por essa via”, explica Forti.
Medicamentos diferenciados
Diferentemente de muitas enzimas envolvidas em cânceres e outras patologias, que se mostram muito presentes ou que têm mutações que as tornam muito ativas, exigindo a ação de drogas que bloqueiem seu funcionamento (a maioria dos medicamentos atua nesse sentido), o gene da PTPN2 apresenta polimorfismos (formas alternativas do gene) que levam à perda de sua função proteica – e isso está ligado ao fato de se agruparem naturalmente. Ou seja, é sua deficiência ou ineficácia enzimática que faz com que o paciente tenha inflamação e reação autoimune exacerbadas.
“Sabendo disso, podemos pesquisar melhor drogas de ação oral, nasal ou injetáveis já existentes que possam atuar diretamente na ativação dessa enzima nos casos em que ela está inativa naturalmente, que é o que ocorre no lúpus, na artrite reumatoide, no diabetes tipo 1, em certos linfomas, no câncer de mama e no glioblastoma [tumor maligno que afeta o cérebro e a coluna]”, afirma Forti.
“Além disso, nosso trabalho abre uma janela interessante de exploração para o desenvolvimento de novas drogas que tenham essas funções, que é o que pretendemos fazer na sequência por meio de varreduras de bibliotecas de compostos sintéticos e/ou naturais por tecnologias apropriadas baseadas nos ensaios que desenvolvemos com este estudo”, acrescenta.
Para contribuir com a missão, o grupo de pesquisadores dos Estados Unidos mantém colaborações com startups de biotecnologia e outras empresas farmacêuticas que estão atentas às últimas descobertas relacionadas a fosfatases, que ainda são alvos farmacológicos pouco explorados.
O artigo Macromolecular crowding amplifies allosteric regulation of T-cell protein tyrosine phosphatase pode ser lido em: www.sciencedirect.com/science/article/pii/S0021925822010985?via%3Dihub.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





