

Machos e fêmeas tiveram diferentes desfechos cardiorrespiratórios e no sono depois de terem sido expostos a canabinoide sintético no útero (ilustração: Luis Gustavo Patrone/Unesp)
Pesquisadores avaliaram fatores comportamentais e fisiológicos em animais cujas mães receberam, durante a gestação, substância sintética capaz de ativar os mesmos receptores que a maconha. Consequências foram diferentes para machos e fêmeas
Pesquisadores avaliaram fatores comportamentais e fisiológicos em animais cujas mães receberam, durante a gestação, substância sintética capaz de ativar os mesmos receptores que a maconha. Consequências foram diferentes para machos e fêmeas
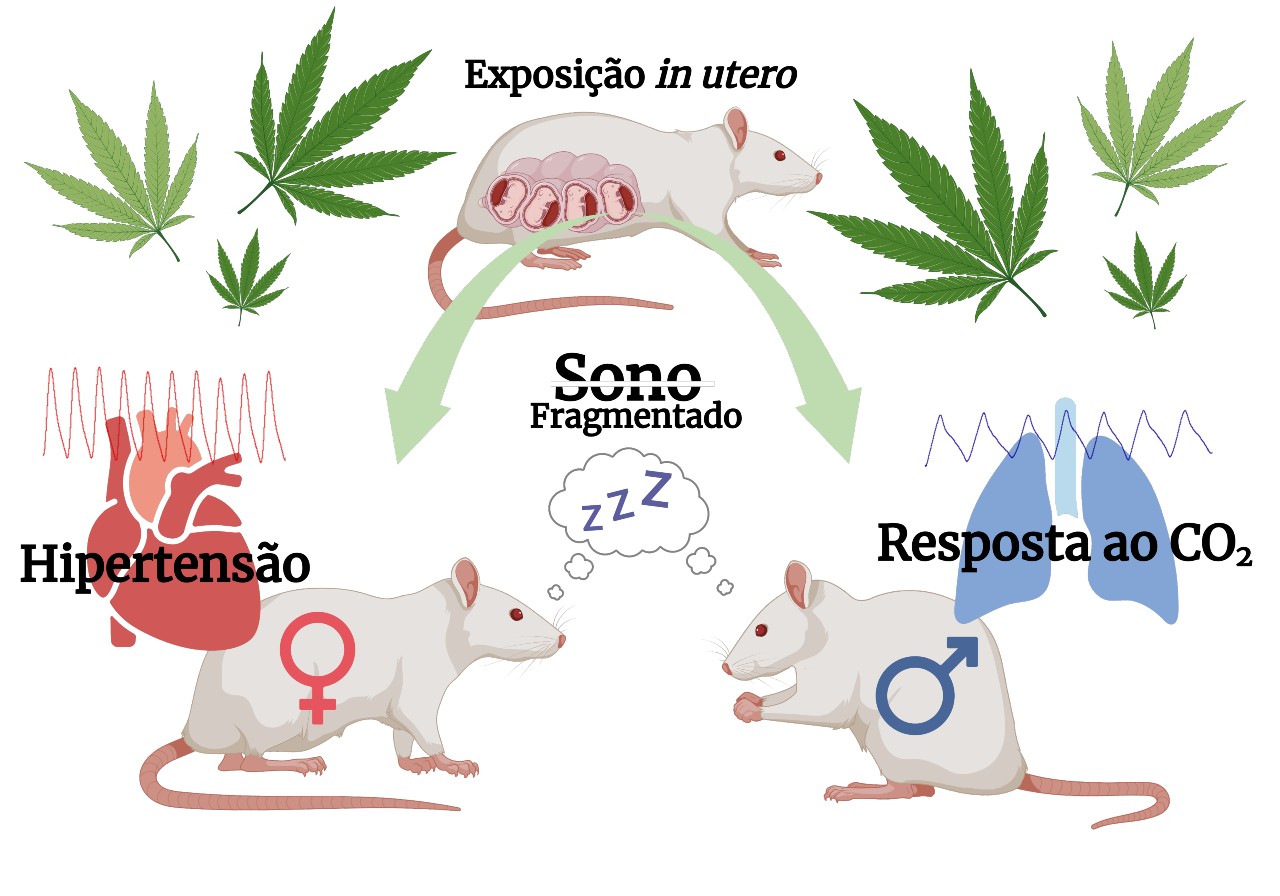
Machos e fêmeas tiveram diferentes desfechos cardiorrespiratórios e no sono depois de terem sido expostos a canabinoide sintético no útero (ilustração: Luis Gustavo Patrone/Unesp)
André Julião | Agência FAPESP – A exposição de ratas grávidas a um canabinoide sintético – capaz de ativar os mesmos receptores cerebrais que a maconha – mostrou que os efeitos da droga nos filhotes se estendem à vida adulta, como problemas cardiovasculares nas fêmeas e maior suscetibilidade a ataques de pânico nos machos. O resultado do estudo, publicado no American Journal of Physiology – Lung Cellular and Molecular Physiology, reacende o alerta sobre o uso desse tipo de substância por mulheres grávidas.
O trabalho foi conduzido com apoio da FAPESP por pesquisadores das universidades Estadual Paulista (Unesp) e de São Paulo (USP). Em estudo anterior, o grupo havia demonstrado os efeitos da exposição intrauterina ao canabinoide em roedores filhotes e juvenis (leia mais em: agencia.fapesp.br/41025).
“Observamos que existem alterações de longo prazo no comportamento, mas principalmente na função cardiorrespiratória dos animais que foram expostos ao canabinoide ainda no útero da mãe. As alterações, porém, variam entre machos e fêmeas”, conta Luis Gustavo Patrone, primeiro autor do estudo, realizado como parte do seu doutorado com bolsa da FAPESP na Faculdade de Ciências Agrárias e Veterinárias (FCAV) da Unesp, em Jaboticabal, onde atualmente realiza seu pós-doutorado.
Diferentemente do que aconteceu com os recém-nascidos no estudo anterior, no experimento atual não houve alterações na respiração basal dos indivíduos adultos (80 dias de vida). O resultado pode ser um indício de algum mecanismo de compensação ao longo do desenvolvimento pós-natal, embora ainda não seja possível apontá-lo.
Um resultado mantido em relação ao trabalho anterior foi que a exposição intrauterina ao canabinoide provocou uma maior sensibilidade respiratória ao dióxido de carbono (CO2) nos machos adultos, um desfecho oposto ao que ocorreu nas fêmeas.
“Em humanos, essa sensibilidade aumentada ao CO2 pode ser um determinante para a ocorrência de episódios de pânico, quando se tem a sensação de não estar conseguindo respirar, ou seja, um falso alarme de sufocamento. Os animais, por sua vez, expressam esse comportamento por meio de tentativas de fuga da câmara de experimento”, explica Luciane Gargaglioni, professora da FCAV-Unesp e coordenadora do estudo.
Função cardiovascular e sono
Os pesquisadores avaliaram ainda fatores cardiovasculares e a qualidade do sono nos animais. O estudo revelou que a exposição ao canabinoide durante o desenvolvimento fetal tornou a prole propensa a disfunções cardiovasculares na idade adulta, com hipertensão e taquicardia sendo mais frequentemente identificadas nas fêmeas.
Quanto à qualidade do sono, os machos apresentaram um padrão mais fragmentado, acordando mais vezes ao longo do período em que foram monitorados. “Somado o tempo total, eles dormem menos”, diz Patrone. As fêmeas expostas, por sua vez, também tiveram uma redução da qualidade do sono, porém, de forma amena.
“A maioria dos estudos científicos avalia os parâmetros apenas em machos, assumindo que os resultados valem para ambos os sexos. No nosso laboratório, sempre fazemos essa distinção e as respostas muitas vezes são bem diferentes, até opostas, como neste estudo”, afirma Gargaglioni.
Uma hipótese que pode explicar as diferenças entre os desfechos observados em machos e fêmeas é a ação dos hormônios próprios de cada sexo. No caso das fêmeas, o estrógeno é conhecido pela ação neuroprotetiva, o que pode estar blindando o encéfalo das ratas da ação deletéria do canabinoide.
Além disso, os mamíferos são conhecidos por ter uma formação mais lenta do sistema respiratório nos machos. Isso ocorre durante o chamado pico de testosterona, que coincide com o período de masculinização e formação dos órgãos sexuais. Esse atraso na maturação dos pulmões, bem como das regiões encefálicas responsáveis pelo controle da função respiratória, torna os machos mais vulneráveis.
Os pesquisadores ressaltam, ainda, que os resultados não decorrem de uma menor atenção das mães expostas ao canabinoide em relação aos seus filhotes. Nos experimentos, estas tiveram os mesmos cuidados que as do grupo controle, que não receberam a substância.
O artigo Long-term effects on cardiorespiratory and behavioral responses in male and female rats prenatally exposed to cannabinoid pode ser acessado em: https://journals.physiology.org/doi/abs/10.1152/ajplung.00042.2024.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





