

Científicos del Centro de Estudios del Genoma Humano y Células Madre de la Universidad de São Paulo reconstituyen el proceso celular del síndrome de Richieri-Costa Pereira (a la izquierda: células de la cresta neural generadas con iPSCs de pacientes con síndrome de Richieri-Costa-Pereira/ imagen: Gerson Kobayashi; a la derecha: células de cresta neural – inmunofluorescencia para vimentina y p75 expresados en este tipo de células/ imagen: Luiz Caires)
Científicos del Centro de Estudios del Genoma Humano y Células Madre de la Universidad de São Paulo reconstituyen el proceso celular del síndrome de Richieri-Costa Pereira
Científicos del Centro de Estudios del Genoma Humano y Células Madre de la Universidad de São Paulo reconstituyen el proceso celular del síndrome de Richieri-Costa Pereira
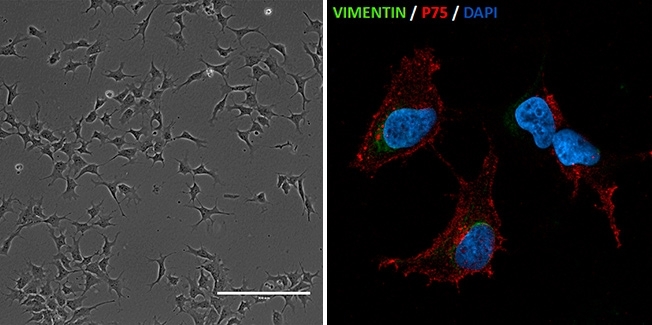
Científicos del Centro de Estudios del Genoma Humano y Células Madre de la Universidad de São Paulo reconstituyen el proceso celular del síndrome de Richieri-Costa Pereira (a la izquierda: células de la cresta neural generadas con iPSCs de pacientes con síndrome de Richieri-Costa-Pereira/ imagen: Gerson Kobayashi; a la derecha: células de cresta neural – inmunofluorescencia para vimentina y p75 expresados en este tipo de células/ imagen: Luiz Caires)
Por Maria Fernanda Ziegler | Agência FAPESP – Están dilucidados los mecanismos celulares y de la expresión génica que derivan en la malformación de la mandíbula, el rasgo más característico del síndrome de Richieri-Costa Pereira.
Científicos del Centro de Investigación sobre el Genoma Humano y Células Madre (CEGH-CEL) de Brasil y de la Duke University, en Estados Unidos, descubrieron que en los casos en que se padece este síndrome, ocurren problemas en los procesos de migración y diferenciación celular durante la formación del cráneo y del rostro, que se concretan durante el primer trimestre de la gestación humana.
El síndrome de Richieri-Costa Pereira es una enfermedad autosómica recesiva descrita por primera vez en 1992 por el profesor Antonio Richieri-Costa y su equipo del Hospital de Rehabilitación de Anomalías Craneofaciales de la Universidad de São Paulo (USP), con sede en la ciudad de Bauru (interior de São Paulo, Brasil). En la actualidad se sabe que hay más de 20 pacientes que padecen esta enfermedad en Brasil (y uno en el exterior), pero el estudio de la misma puede suministrar pistas importantes con respecto a la formación craneofacial durante el desarrollo fetal e incluso para la bioengeniería.
Los investigadores del CEGH-CEL –un Centro de Investigación, Innovación y Difusión (CEPID) de la FAPESP con sede en la USP– ya habían descubierto en 2014 que mutaciones presentes en el gen EIF4A3 están relacionadas con ciertas anomalías ocasionadas por este síndrome. En un artículo publicado recientemente en Human Molecular Genetics se describen los mecanismos celulares que desencadenan la malformación, al reconstituir las etapas del desarrollo craneofacial.
La formación de la cabeza es compleja: comprende diversas etapas y varios procesos. Para que se concrete, es necesario que exista proliferación celular, como así también migración celular y muerte celular programada, que es la llamada apoptosis. Los investigadores observaron que pacientes con este síndrome padecen problemas de migración celular durante el proceso de formación craneofacial.
“De haber problemas de migración, habrá entonces menos células poblando los tejidos que se formen: la mandíbula y otros componentes del complejo craneofacial, por ejemplo. Creemos que la merma de la cantidad de células, producto de una migración defectuosa, redundaría en una menor cantidad de células para generar esos tejidos”, dijo Gerson Kobayashi, uno de los autores del estudio, cuya tesis doctoral fue referente a este tema.
La reconstitución in vitro de las etapas del desarrollo craneofacial se realizó partiendo de células somáticas –células madre de pulpa de dientes o fibroblastos o también células de la sangre– extraídas de pacientes portadores del síndrome de Richieri-Costa Pereira.
Luego esas células se reprogramaron para que se convirtieran en células pluripotentes, parecidas a las células madre embrionarias. Esto permitió crear células de la cresta neural (las encargadas de formar la mayor parte de los huesos y cartílagos del complejo craneofacial) y células que luego de alcanzar un alto grado de diferenciación se vuelven mesenquimales (células con elevada plasticidad, que pueden originar diversos tejidos).
“Con las células de cresta neural logramos observar esos tres procesos y detectar si alguno de ellos está comprometido en los pacientes. La proliferación y la apoptosis están bien, pero no así la migración. Lo importante es que las células de la cresta neural, al llegar a una determinada zona, se diferencien. Pusimos a prueba la diferenciación en cartílagos y tejidos óseos y confirmamos que ambos procesos están comprometidos”, dijo la profesora Maria Rita Passos-Bueno, coordinadora del Laboratorio de Diagnóstico Molecular de Enfermedades del CEGH-CEL.
Para mejorar el pronóstico de las cirugías
Científicos de la Duke University replicaron los estudios in vitro realizados en el CEGH-CEL en un modelo animal. Kobayashi estima que será posible emplear este modelo en la búsqueda de drogas que reviertan el fenotipo de las células y que pueda utilizárselas en casos de embarazos de riesgo. La idea es que los resultados de este estudio puedan servir de base para la realización de cirugías más eficientes.
“Observamos que existe la capacidad de formar el hueso, pero que ello sucede en la época equivocada. La próxima pregunta que ha de responderse es si será posible intervenir a la hora de hacer una cirugía, porque estos pacientes deben someterse a diversos procedimientos quirúrgicos. Así sería posible administrar sustancias a los efectos de que se produzca un proceso de reconstitución ósea más eficiente, lo cual propicia un mejor pronóstico de la cirugía”, dijo Pasos-Bueno.
La investigadora estima que los descubrimientos sobre los mecanismos del síndrome Richieri-Costa Pereira pueden ser relevantes para los estudios de bioengeniería de tejidos.
“El gen EIF4A3 parece cumplir un importante rol en la formación de la mandíbula, y existe un interés en la producción de estructuras óseas en laboratorio, que podrán emplearse en reemplazo de tejidos óseos comprometidos. Para ello es necesario saber cuáles son las moléculas críticas, por ejemplo, a los efectos de asegurarse de que la mandíbula tenga un determinado tamaño. La aplicación del conocimiento a largo plazo es para los pacientes, pero también lo es para la bioingeniería de tejidos”, dijo Pasos-Bueno.
Puede leerse el artículo intitulado EIF4A3 deficient human iPSCs and mouse models demonstrate neural crest defects that underlie Richieri-Costa-Pereira syndrome, de Emily E. Miller, Gerson S. Kobayashi, Camila M. Musso, Miranda Allen, Felipe A.A. Ishiy, Luiz Carlos de Caire Jr., Ernesto Goulart, Karina Griesi-Oliveira, Roseli M. Zechi-Ceide, Antonio Richieri-Costa, Debora R. Bertolam, Maria Rita Passos-Bueno y Debra L. Silver, en el siguiente enlace: https://doi.org/10.1093/hmg/ddx078.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





