

En el estudio se identificó el sitio crítico para la detección de amenazas en el cerebro de roedores (imagen: Pexels*)
Se aplicaron a tal fin técnicas de punta en el marco de una investigación realizada con roedores en la Universidad de São Paulo, en Brasil, y publicada en la revista Current Biology
Se aplicaron a tal fin técnicas de punta en el marco de una investigación realizada con roedores en la Universidad de São Paulo, en Brasil, y publicada en la revista Current Biology

En el estudio se identificó el sitio crítico para la detección de amenazas en el cerebro de roedores (imagen: Pexels*)
Por Ricardo Muniz | Agência FAPESP – En un artículo publicado en la revista Current Biology se describen los experimentos que han permitido mapear con precisión los lugares existentes en el cerebro responsables de la identificación inmediata de amenazas y de la formación de la memoria del miedo.
“Estábamos interesados en ver una zona del cerebro relacionada con la señalización del miedo: de qué manera la misma podría detectar ambientes relacionados previamente con una amenaza física o predatoria, tal como un sitio en el cual el individuo sufrió un estímulo físico de eversión [que provoca destrucción]”, comenta Newton Sabino Canteras, profesor titular del Departamento de Anatomía del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (ICB-USP), en Brasil, y uno de los autores del artículo.
Se sabe que el hipocampo está implicado en la navegación espacial y en la orientación del cuerpo en el ambiente, y también en la atención a las amenazas ambientales. El registro de lo peligroso será “arrojado” allí, de manera tal que es posible computar en el ambiente de dónde proviene la amenaza, según lo explica el científico. Otra estructura que forma parte del hipocampo es el subículo.
“Ésta es básicamente la estrella del espectáculo: le transfiere la información relacionada con la amenaza ambiental al hipotálamo. Por eso nuestra pregunta fue entonces de qué manera se comporta esta estructura cuando el animal se encuentra en un ambiente previamente asociado a un estímulo aversivo”, comenta Sabino Canteras.
Para observar la actividad de ese núcleo, el grupo utilizó fotometría de fibra. “Pusimos un virus que expresa una proteína sensible a la entrada del calcio y puede registrar la actividad celular. En la medida en que existe actividad celular, va emitiendo más fluorescencia.”
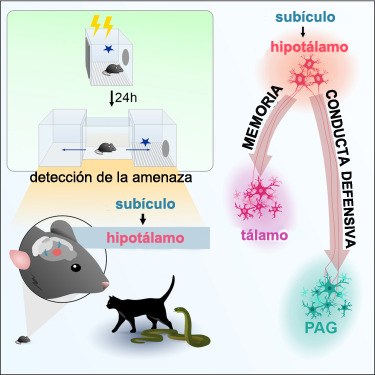
Resumen gráfico de la investigación (crédito: Juliette M.A. Viellard et al./Current Biology)
El paradigma conductual que se aplicó consistió en habituar a un ratón en una estructura compuesta con dos cajas unidas por un pasadizo. En una de esas cajas, el roedor quedó confinado y se le aplicaron estímulos físicos aversivos (descargas eléctricas en las patas). Al día siguiente, se lo puso al animal en la estructura experimental de manera tal que evitara la caja aversiva.
“Normalmente, cuando se lo testea de este modo, el ratón estira su cuerpecito, va y vuelve, pero no entra más en la caja en donde se le aplicó la descarga: manifiesta una serie de reacciones de evitación.”
En el análisis fotométrico enfocado en el núcleo dorsal premamilar (PMd), una interfaz crítica del circuito neuronal investigado, se detectó que el PMd permanece particularmente activo cuando el animal se dirige hacia el sitio aversivo y exhibe un aumento aún mayor de la actividad cuando se ubica cerca de la fuente de la amenaza.
“Por ende, se trata, de un detector de amenaza muy claro, que interactúa en forma dinámica con la fuente. Si el roedor le da la espalda, no se activa, pero si mira hacia allí o se ubica cerca, el PMd ‘pitará’, y éste es uno de los grandes hallazgos de este trabajo”, informa Sabino Canteras.
Posteriormente, los investigadores inactivaron ese núcleo aplicando quimiogenética (designer receptors exclusively activated by designer drug – Dreadd). “Inyectamos un virus, y ese virus expresa un receptor [la proteína hM4Di] que, en presencia de una droga específica, ‘silenciará’, es decir, impedirá que esas células se disparen. Queda silenciado solamente en el momento en que le aplico la droga. En el momento en que la quito, funciona normalmente”, detalla Sabino Canteras. “Cuando efectúo esa inactivación del núcleo, el animal reduce drásticamente la respuesta de defensa, deja de evitar la caja amenazadora y entra en ella como si el ambiente fuese inocuo, como si no hubiese sucedido nada.”
Se notó entonces que la inactivación del PMd influye tanto sobre la expresión de las respuestas de defensa como en el proceso de reafirmación de la memoria del miedo. En otras palabras, tras la inactivación del PMd, el animal registra el ambiente como seguro y al día siguiente transita por él como si no revistiese ningún riesgo.
Luego se investigaron los papeles funcionales de los principales blancos del PMd, es decir: la sustancia gris periacueductal (PAG) y el tálamo medial anterior (AM), dos sitios del sistema nervioso, uno en el tronco y el otro en el tálamo.
“Existe una técnica con la cual puedo inactivar específicamente la proyección que va hacia el tronco o la que va hacia el tálamo. Pongo un virus en el PMd que expresa una proteína que es un canal de cloro sensible a la luz. Cuando arrojo luz en los campos terminales, esas terminaciones silencian, entonces puedo manipular una vía específica de proyección.”
Los investigadores verificaron que cuando se inactiva la vía de la proyección para la PAG, el efecto de ello es la diminución de la conducta de defensa al momento de la inactivación de esa vía. Pero al día siguiente, el roedor responde bien al miedo, es decir, no se altera la memoria.
“Influirá fundamentalmente sobre la expresión de la conducta, pero no sobre la reafirmación de la memoria del miedo”, detalla el investigador. “Por otra parte, cuando se concreta una inactivación para el tálamo, prácticamente no hay efecto inmediato, pero sí un gran efecto sobre la reafirmación de la memoria del miedo”. De este modo, ambos sucesos están siendo mediados fundamentalmente por sitios distintos de proyección del núcleo.
Los primeros autores del artículo son Juliette Viellard (ICB e Institut des Maladies Neurodégénératives de la Universidad de Bordeos, Francia) y Fernando Melleu (ICB), y sus coautores son Alicia Tamais, Alisson de Almeida, Carolina Zerbini, Juliane Ikebara, Karolina Domingues, Miguel de Lima, Simone Motta (todos del ICB) y Fernando A. Oliveira, del Laboratorio de Neurobiología Celular y Molecular del Centro de Matemática, Computación y Cognición de la Universidad Federal del ABC.
El grupo de científicos contó con el apoyo de la FAPESP en el marco diez proyectos (17/12881-2, 14/05432-9, 16/18667-0, 19/27245-0, 16/08640-7, 22/07530-4, 21/02864-9, 22/16318-9, 21/01642-2 y 18/25857-5).
Puede leerse el artículo intitulado A subiculum-hypothalamic pathway functions in dynamic threat detection and memory updating en este enlace: www.sciencedirect.com/science/article/abs/pii/S0960982224006043.
*Foto de Tanner Johnson en Pexels
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





