
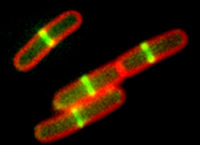
Projeto apoiado em chamada da Rede de Biologia Estrutural em Tópicos Avançados de Ciências da Vida – SMOLBnet 2.0 procura entender o mecanismo natural de interação entre proteínas que inibem a divisão bacteriana (divulgação)
Projeto apoiado em chamada da Rede de Biologia Estrutural em Tópicos Avançados de Ciências da Vida – SMOLBnet 2.0 procura entender o mecanismo natural de interação entre proteínas que inibem a divisão bacteriana
Projeto apoiado em chamada da Rede de Biologia Estrutural em Tópicos Avançados de Ciências da Vida – SMOLBnet 2.0 procura entender o mecanismo natural de interação entre proteínas que inibem a divisão bacteriana

Projeto apoiado em chamada da Rede de Biologia Estrutural em Tópicos Avançados de Ciências da Vida – SMOLBnet 2.0 procura entender o mecanismo natural de interação entre proteínas que inibem a divisão bacteriana (divulgação)
Por Mônica Pileggi
Agência FAPESP – Compreender a interação natural entre duas proteínas para inibir a divisão de uma bactéria – e, dessa forma, possivelmente evitar a sua proliferação – é tema de proposta aprovada na chamada da Rede de Biologia Estrutural em Tópicos Avançados de Ciências da Vida – SMOLBnet 2.0.
O projeto "SMOLBnet 2.0: combinando genética e RMN para dissecar interações proteína-proteína fundamentais para o funcionamento do complexo de divisão bacteriana", coordenado pelo professor Frederico José Gueiros Filho, do Departamento de Bioquímica do Instituto de Química da Universidade de São Paulo, pretende estudar como a proteína conhecida como FtsZ interage com outras duas presentes na bactéria: MinC e MciZ.
A equipe do laboratório de Gueiros há anos vem desvendando o que se passa dentro das células das bactérias, especificamente o trabalho das proteínas que promovem a divisão.
“Existe um grupo de cerca de 20 proteínas especializadas em executar a divisão das bactérias. O maestro de todas é a FtsZ. Ela é interessante porque tem a capacidade de encontrar o exato local onde a célula precisa se dividir. Ao formar uma ‘cintura’ na parte interna da bactéria, ela atrai outras proteínas de divisão para esse anel que acabou de formar”, disse Gueiros à Agência FAPESP.
São essas proteínas atraídas por FtsZ que alteram a parede externa da bactéria. No momento da divisão, a parede da bactéria para de se expandir no comprimento e passa a crescer para dentro, formando um disco ou septo, que separa a bactéria em duas células filhas.
Um aspecto importante do processo de divisão é que ele precisa ser bem regulado e não pode ocorrer a qualquer momento. Para isso, a própria bactéria possui proteínas que funcionam como inibidores naturais da divisão. Um exemplo é a proteína MinC, que se liga à proteína FtsZ e impede que ela forme o anel de divisão na hora e locais errados.
Ao estudar o efeito da proteína MinC sobre FtsZ, a equipe deseja primeiro entender o processo natural de inibição da divisão. “Não há dúvidas, no entanto, de que as informações obtidas poderão servir de inspiração para o desenvolvimento de um antibiótico capaz de impedir a proliferação das bactérias. É como se fosse um processo de engenharia reversa: nós estudamos o inibidor da bactéria e usamos os princípios aprendidos para fazer o nosso inibidor”, explicou Gueiros.
Os testes do projeto, cujo início está previsto para março deste ano, serão realizados com Bacillus subtilis. “Essa bactéria, que vive no solo e não é patogênica, é o que chamamos de um sistema modelo. É um organismo muito fácil de ser estudado e que serve de exemplo para outros. Como o mecanismo de divisão é semelhante em todas as bactérias – todas têm FtsZ –, o que aprendemos com Bacillus subtilis é aplicável a muitas outras espécies, inclusive as patogênicas”, disse.
Formas complementares
As proteínas são formadas por diversas moléculas de aminoácidos encadeadas. Seu formato tridimensional globular lembra um coral esférico, com cavidades e saliências na superfície. Para ligar umas às outras, essas proteínas devem ter, além da afinidade química, uma complementaridade de formas.
Para saber que partes de FtsZ e MinC estão envolvidas nesse encaixe a equipe do Instituto de Química da USP já identificou mais de uma dúzia de mutantes de FtsZ, ou seja, variantes nas quais um aminoácido dessa proteína foi substituído e por isso elas deixaram de serem inibidas pela MinC.
“Quando localizamos a variação, aprendemos sobre o funcionamento da proteína. Observamos que as mutações estão muito próximas umas das outras. Isso nos dá um indício de que aquela região é importante para a proteína ligar-se a outra”, disse Gueiros.
Segundo ele, o próximo passo será refinar o estudo com o uso da ressonância magnética nuclear (RMN), uma técnica de alta precisão por meio da qual será possível observar quais são os átomos envolvidos na interação das proteínas estudadas.
“A ressonância magnética nuclear permite confirmar o que cada um desses mutantes representa no sítio de interação entre FtsZ e MinC. A técnica também irá expandir o que já encontramos sem o seu uso. Acreditamos que existam outros aminoácidos envolvidos nessa interação”, indicou.
O estudo conta com a colaboração da pesquisadora Ana Carolina de Mattos Zeri, coordenadora do Laboratório Multiusuário de Ressonância Magnética Nuclear do Laboratório Nacional de Biociências (LNBio), parte do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM).
O grupo também pretende usar a ressonância para determinar a estrutura tridimensional de MciZ, a única das três proteínas cuja disposição dos átomos e seu mecanismo de inibição ainda são desconhecidos.
Além dos coordenadores, o projeto envolverá doutorandos e uma pós-doutora. Há interesse também na incorporação de mais um pós-doutor.
“Haverá sinergia de expertises, como divisão bacteriana e ressonância magnética nuclear. Pretendemos unir essas duas especialidades para fazer uma ciência ainda melhor do que poderíamos fazer de forma isolada”, afirmou Gueiros. Candidatos interessados em participar do projeto podem enviar currículos para fgueiros@iq.usp.br.
Mais informações sobre a chamada SMOLBnet 2.0: www.fapesp.br/smolbnet.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





