

Células madre de glioblastoma, con marcaje fluorescente para proteína priónica (rojo), proteína CD44 (verde) y núcleo celular (azul) (imagem: Marilene Hohmuth Lopes e Mariana Prado/ICB-USP)
En experimentos realizados en la Universidad de São Paulo, las células madre tumorales se volvieron menos capaces de proliferar e invadir tejidos cuando se bloqueó la producción de la proteína priónica mediante edición genética; los resultados sugieren que la molécula puede ser un blanco terapéutico
En experimentos realizados en la Universidad de São Paulo, las células madre tumorales se volvieron menos capaces de proliferar e invadir tejidos cuando se bloqueó la producción de la proteína priónica mediante edición genética; los resultados sugieren que la molécula puede ser un blanco terapéutico
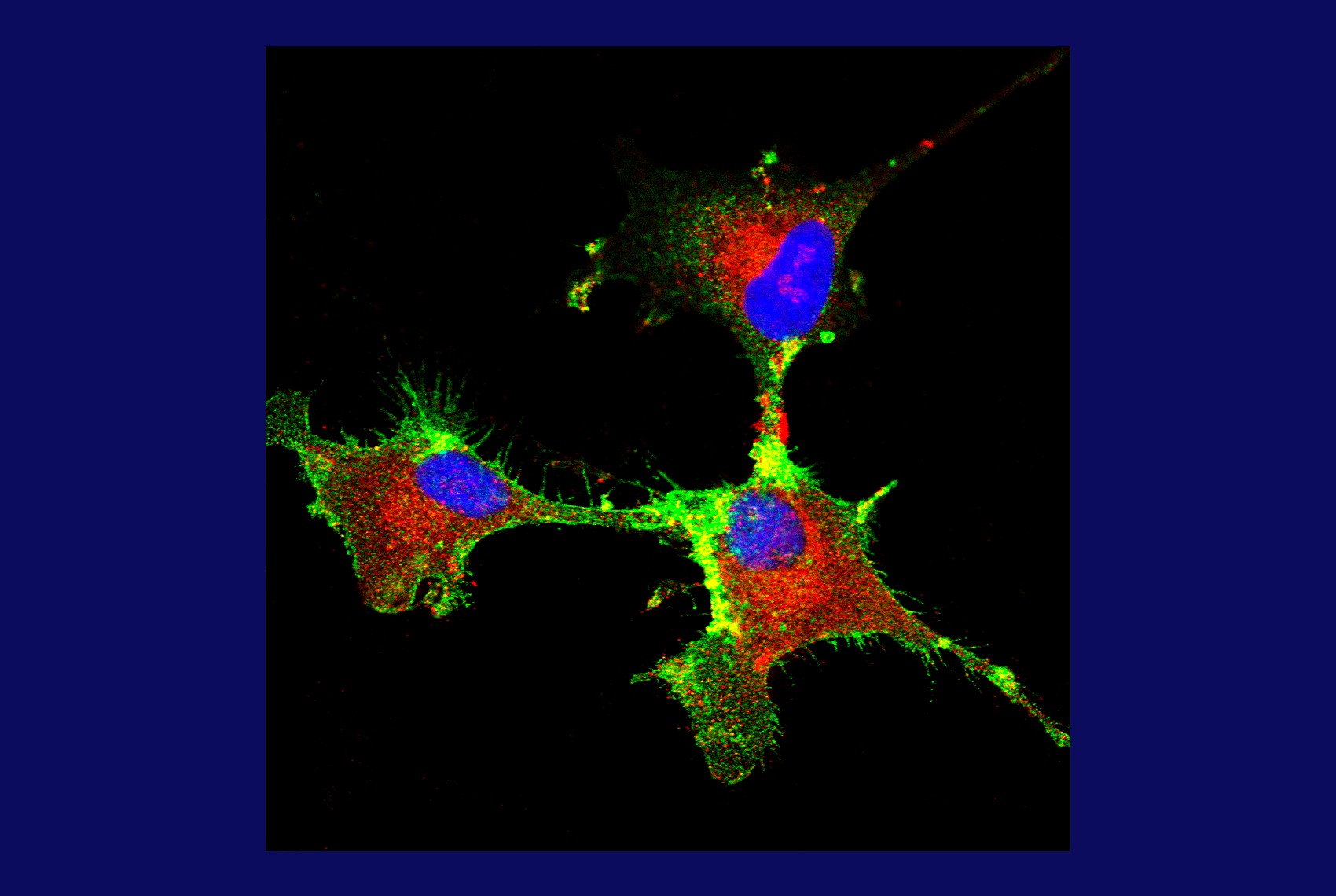
Células madre de glioblastoma, con marcaje fluorescente para proteína priónica (rojo), proteína CD44 (verde) y núcleo celular (azul) (imagem: Marilene Hohmuth Lopes e Mariana Prado/ICB-USP)
Por Fernanda Bassette | Agência FAPESP – El glioblastoma (GBM), uno de los tipos más agresivos de cáncer cerebral, constituye uno de los mayores desafíos para la medicina, tanto por la dificultad de su tratamiento como por su elevada tasa de letalidad. En Brasil, aunque no hay cifras exactas, se estima que anualmente se diagnostican entre 10.000 y 12.000 nuevos casos.
La enfermedad, que representa casi la mitad (49%) de los tumores cerebrales, tiene una tasa de supervivencia extremadamente baja: la mayoría de los pacientes viven aproximadamente 12 meses después del diagnóstico. Por ello, desde hace años, la ciencia busca nuevos blancos terapéuticos para desarrollar tratamientos más eficaces capaces de aumentar la supervivencia y la calidad de vida de estos pacientes.
El tratamiento tradicional implica cirugía para extirpar el tumor, quimioterapia y radioterapia. El principal fármaco utilizado es la temozolomida (TMZ), un fármaco de quimioterapia aprobado a finales de la década de 1990 y que todavía se utiliza para controlar la enfermedad. El problema es que, aunque el paciente puede estar libre del tumor durante unos meses, el glioblastoma rara vez responde completamente al tratamiento y, por lo tanto, vuelve a desarrollarse meses después, a menudo de forma aún más agresiva e invasiva.
Fue a partir de este escenario que el grupo liderado por la profesora Marilene Hohmuth Lopes, del Laboratorio de Neurobiología y Células Madre del Departamento de Biología Celular y del Desarrollo del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (ICB-USP), en Brasil, decidió profundizar e investigar el mecanismo de acción de las células tumorales que permanecen en el tejido cerebral incluso después del tratamiento completo.
En un estudio apoyado por la FAPESP y publicado en la revista BMC Cancer, el equipo descubrió que la proteína priónica desempeña un papel clave en la biología del glioblastoma.
“El tratamiento del glioblastoma ha estado estancado durante más de 20 años. Es fundamental descubrir nuevas estrategias para mejorar las posibilidades de recuperación y supervivencia de los pacientes”, declaró Lopes a Agência FAPESP.
Células madre tumorales
Para comprender la importancia de la proteína priónica en la biología del cáncer, primero es necesario conocer el mecanismo de acción del glioblastoma. Como explica Lopes, la cirugía y el tratamiento con temozolomida matan las células que se multiplican rápidamente y forman la “masa” tumoral. A pesar de ello, las llamadas células madre tumorales (o células madre del glioblastoma) permanecen retenidas en el tejido cerebral en un estado latente. Cuando vuelven a estar activos, son capaces de orquestar nuevamente el crecimiento del tumor.
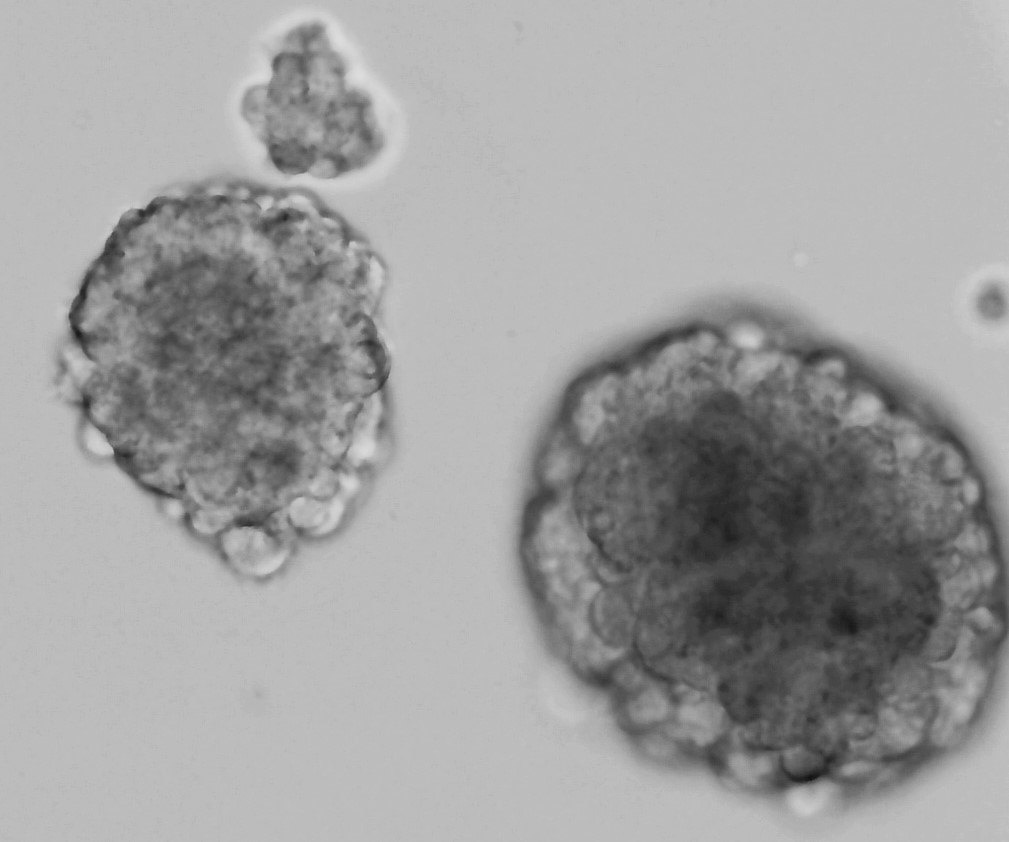
Células-madre de glioblastoma cultivadas en suspensión como esferas (foto: Rodrigo Nunes Alves)
“Es importante recordar que las células madre son muy potentes y tienen la capacidad de autorrenovarse. Permanecen inactivas por un período, pero cuando ‘despiertan’, generan nuevas células que se multiplican rápidamente y reconstruyen toda la jerarquía celular del tumor. Y eso fue lo que llamó nuestra atención“, cuenta la profesora.
Proteína priónica
Todas las personas producen una proteína llamada priónica, que desempeña funciones biológicas relevantes y extremadamente importantes para el mantenimiento del sistema nervioso central: esta proteína participa en la funcionalidad y plasticidad del cerebro, está involucrada en procesos cognitivos (como la formación y consolidación de la memoria, por ejemplo) y contribuye a la comunicación entre las neuronas.
“Yo ya estudiaba esta proteína antes de comenzar a investigar su papel en el desarrollo del cáncer. Cuando observamos, en muestras de pacientes, que estaba elevada en tumores muy agresivos, decidimos comprender mejor su relación con el glioblastoma y su influencia sobre las células madre del tumor, que son las responsables de la recaída del cáncer”, relata.
Esto es importante porque la proteína priónica está presente en la superficie de las células, lo que la convierte en “druggable” (un blanco capaz de ser modulado por medicamentos).
“Esto significa que, al pensar en una posible terapia, es mucho más fácil atravesar la barrera hematoencefálica y alcanzar una proteína que está en la superficie de la célula que una que se encuentra dentro de ella”, explica la profesora.
En los experimentos in vitro, el grupo observó que, al cultivar las células madre de glioblastoma, había un aumento significativo en los niveles de la proteína priónica, lo que sugiere que juega un papel fundamental en la regulación de estas células.
Edición genética
A partir de este hallazgo, el grupo utilizó la tecnología CRISPR-Cas9 para editar el genoma de las células madre de glioblastoma y bloquear la producción de la proteína priónica en estas células. Con esto, los investigadores lograron modificar el funcionamiento de estas células madre tumorales, reduciendo su capacidad de invasión y proliferación.
“Esto nos mostró que la proteína priónica es un posible blanco terapéutico. Sin embargo, es poco probable que una sola proteína, por sí sola, sea responsable del desarrollo de la enfermedad. Creemos que actúa en diferentes vías de señalización, por lo que seguimos investigando otros mecanismos y posibles interacciones con otras proteínas”, detalla Lopes.
El grupo comenzó entonces a estudiar la interacción de la proteína priónica con la proteína CD44, un marcador bien conocido de células madre cancerígenas, involucrado en la invasión colectiva del cáncer de mama y colorrectal.
“Descubrimos recientemente que una molécula modula a la otra, y ahora buscamos entender mejor esta interacción. Hasta el momento, sabemos que la proteína priónica puede funcionar como un andamiaje, creando plataformas multiproteicas de señalización en la membrana de las células para que estas sobrevivan y proliferen. Cuando alteramos la producción de esta proteína [a través de CRISPR-Cas9], descubrimos que su ausencia compromete la autorrenovación, la migración y la invasión de las células tumorales”, resalta.
A pesar de los prometedores resultados, todavía no es posible predecir cuándo estos nuevos descubrimientos podrán aplicarse a la práctica clínica. “Trabajamos con investigación básica. Se necesitarán muchos años para que podamos traducir estos descubrimientos en tratamientos. Pero estamos en el proceso de comprender los mecanismos, de comprender cómo esta proteína regula otros genes importantes en la biología celular y tumoral y cómo puede, en el futuro, convertirse en un potencial blanco terapéutico. El estudio continúa”, concluye la investigadora.
El artículo Prion protein regulates invasiveness in glioblastoma stem cells puede ser leído en: bmccancer.biomedcentral.com/articles/10.1186/s12885-024-13285-4 .
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





