

A la izquierda, el pulmón de un ratón no inmunizado e infectado con M. tuberculosis; a la derecha, el pulmón de un animal inmunizado con la vacuna BCG recombinante y posteriormente infectado (crédito: Instituto Butantan)
Científicos del Instituto Butantan de São Paulo y colaboradores revelan por qué la BCG recombinante induce una respuesta más intensa y duradera que la vacuna convencional
Científicos del Instituto Butantan de São Paulo y colaboradores revelan por qué la BCG recombinante induce una respuesta más intensa y duradera que la vacuna convencional
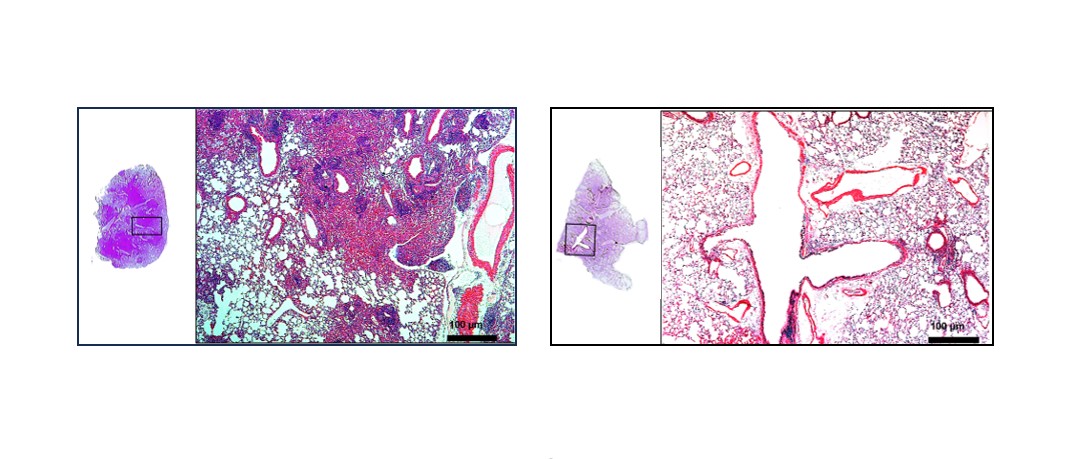
A la izquierda, el pulmón de un ratón no inmunizado e infectado con M. tuberculosis; a la derecha, el pulmón de un animal inmunizado con la vacuna BCG recombinante y posteriormente infectado (crédito: Instituto Butantan)
Por Karina Toledo, desde Shenzhen | Agência FAPESP – Científicos del Instituto Butantan de São Paulo y colaboradores están desarrollando una versión más potente de la vacuna BCG, que protege contra la tuberculosis. Mientras que el inmunógeno convencional disminuyó en un 90 % la infección en los experimentos con ratones, con la llamada BCG recombinante el índice de protección trepó al 99 %. Asimismo, la nueva fórmula protegió a los animales de prueba durante un período de tiempo significativamente más largo.
“La BCG es la primera vacuna que nos aplican al nacer y es efectiva en la protección de los niños. Pero la inmunidad contra esta enfermedad tiende a decaer durante la vida adulta, y como las bacterias están volviéndose resistentes a los antibióticos, nadie está seguro. Por eso se ha llevado a cabo un esfuerzo mundial para intentar mejorar la prevención contra la tuberculosis pulmonar adulta. Actualmente se registran alrededor de 10 millones de nuevos casos y 1,5 millones de muertes anuales en el mundo”, le dice a Agência FAPESP Luciana Cezar de Cerqueira Leite, investigadora del Laboratorio de Desarrollo de Vacunas del Butantan, quien cuenta con el apoyo de la FAPESP.
Para entender por qué la BCG recombinante lleva a una respuesta inmunitaria más intensa y duradera, el grupo del Butantan y sus colaboradores de diversos países han implementado un abordaje conocido como biología de sistemas, que consiste sintéticamente en observar en el modelo animal el comportamiento de miles de genes en diferentes tejidos (fundamentalmente en los pulmones y en los ganglios linfáticos), en el transcurso de todo el montaje de la respuesta inmunitaria. Esta labor comprende la secuenciación de centenares de muestras, seguida de un intenso trabajo de bioinformática y minería de datos.
Cezar de Cerqueira Leite abordó este tema el pasado 29 de junio, durante su conferencia en la FAPESP Week China. En ese mismo panel, dedicado a temas de salud y biomedicina, participaron también Zhang Zhiyong, de la Universidad de Medicina de Guangzhou; Pedro Moraes-Vieira, de la Universidad de Campinas (Unicamp); Xin Jin, científico en jefe de Investigación Científica de la empresa china BGI, y Dan Zhang, cofundador de la compañía Hillgene BioPharma, también de China. Los mediadores fueron Xin Jin (BGI) y Simone Appenzeller, docente de la Unicamp.
“Secuenciamos todo el ARN expresado que se encuentra presente en las muestras extraídas en diversos momentos: antes de que los animales fuesen inmunizados, siete y 90 días después de la inmunización –cuando se hace efectivo el desafío [se les inocula la bacteria en sus narices a los roedores]– y siete y 90 días después del desafío”, comenta Cezar Cerqueira Leite.
Se compararon muestras de tres grupos de ratones: uno no inmunizado, otro al que se le aplicó la BCG convencional y un tercero vacunado con la BCG recombinante. En cada momento del estudio, se compararon qué genes aparecían con la expresión aumentada o disminuida en los distintos grupos.
“Con siete días de inmunización, fue posible ver un cambio muy grande en el grupo al que se le aplicó la versión recombinante: alrededor de 200 genes estaban activándose, mientras que en el grupo de la BCG convencional aún no estaba ocurriendo casi nada. Al cabo de 90 días, la respuesta a la BCG convencional empieza a decaer, mientras que en el grupo de la recombinante se mantiene. Pero la gran novedad reside en que ambas vacunas actúan por caminos metabólicos muy distintos, y nosotros logramos mapearlos. Los datos se publicarán en breve”, revela la investigadora.

Luciana Cezar de Cerqueira Leite, investigadora del Instituto Butantan (foto: Karina Toledo/Agência FAPESP)
Una bacteria potenciada
Omnipresente en las maternidades brasileñas, la vacuna BCG fue creada hace más de 100 años a partir de la atenuación de la bacteria causante de la tuberculosis bovina (Mycobacterium bovis), que es muy parecida a la de la tuberculosis humana (M. tuberculosis).
En tanto, la versión recombinante “obtuvo” −mediante ingeniería genética− la capacidad de elaborar un fragmento de una toxina originariamente secretada por la bacteria Escherichia coli, una especie comúnmente presente en el intestino humano.
“Algunas bacterias E. coli producen toxinas sensibles al calor, conocidas por sus siglas LT [del inglés heat-labile toxin], que son altamente inmunogénicas, es decir, que inducen una fuerte respuesta del sistema inmunitario. En la vacuna recombinante, empleamos un fragmento detoxificado de la toxina LT [denominado LTAK63]. El mismo no es capaz de provocar la enfermedad, pero mantiene la inmunogenicidad, por eso funciona como un adyuvante de la vacuna BCG”, explica Cezar Cerqueira Leite.
Tal como lo explicó la investigadora, los primeros estudios en los cuales se aplicó la estrategia de la BCG recombinante apuntaban al desarrollo de una vacuna neonatal contra la coqueluche o tosferina. “Sucede que la BCG puede aplicarse al nacer, mientras que el inmunógeno que actualmente se encuentra disponible contra la tosferina [la vacuna triple bacteriana o DPT] solamente brinda protección a partir de los seis meses de edad. En este caso, empleamos un fragmento de la toxina producida por la bacteria de la tosferina [Bordetella pertussis]”, explica.
Frente a los resultados prometedores, la misma plataforma está empleándose en la búsqueda de nuevas y mejores vacunas contra la tosferina, la tuberculosis, la neumonía (causada por Streptococcus pneumoniae o neumococo) y la esquistosomiasis, como así también en el tratamiento del cáncer de vejiga (en este último caso, se aplica la vacuna para “despertar” al sistema inmunitario, estimulándolo a atacar al tumor).
En los experimentos realizados con el modelo animal de tuberculosis, se observó que la BCG recombinante disminuye 100 veces la cantidad de bacterias existentes en los pulmones y también reduce la inflamación en los órganos. “Al intentar matar a las bacterias, las células de defensa terminan atacando todo lo que está cerca y causan lesiones en los tejidos. Pero los pulmones de los animales inmunizados con la BCG recombinante aparecen blanquitos, menos inflamados. Ahora, al detallar el mecanismo de acción de cada una de ambas vacunas, entendemos por qué ocurre eso”, Cezar Cerqueira Leite.
Toda la parte de la secuenciación del ARN se concretó en Shenzhen, en China, en las instalaciones de la empresa BGI, que suministra servicios de genómica para laboratorios de todo el mundo. Colaboraron en los estudios científicos del Shenzhen Institute of Advanced Technology, de la Universidad de São Paulo (USP), de la Facultad Israelita de Ciencias de la Salud Albert Einstein, de la Fundación Fiocruz de Bahía, de la compañía farmacéutica Novartis/GSK, del Institut Pasteur y de la Universidad Federal de Goiânia (UFG), en Brasil, entre otros asociados.
Antes de iniciar los estudios clínicos, el grupo de científicos pretende concretar una tanda más de pruebas en animales bovinos. Según Cezar Cerqueira Leite, esperan que la producción de los lotes experimentales del inmunógeno se concrete en 2025 y que las pruebas empiecen al año siguiente. “En humanos podríamos empezar los ensayos después, pero eso será más caro y tendremos que conseguir financiación”.
Para saber más sobre la FAPESP Week China, ingrese aquí: fapesp.br/week/2024/china.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





