

Células tumorais de câncer de próstata. Em vermelho, as mitocôndrias das células. Em verde, os feixes de filamentos da enzima glutaminase. Em ciano o citoplasma da célula, e em azul escuro o DNA nuclear. A coloração amarela se dá pela sobreposição de verde e vermelho, onde estão os filamentos de glutaminase (imagem: CNPEM/divulgação)
Homenagem a trabalho conduzido no CNPEM foi feita em artigo que celebra os 30 anos da revista científica
Homenagem a trabalho conduzido no CNPEM foi feita em artigo que celebra os 30 anos da revista científica
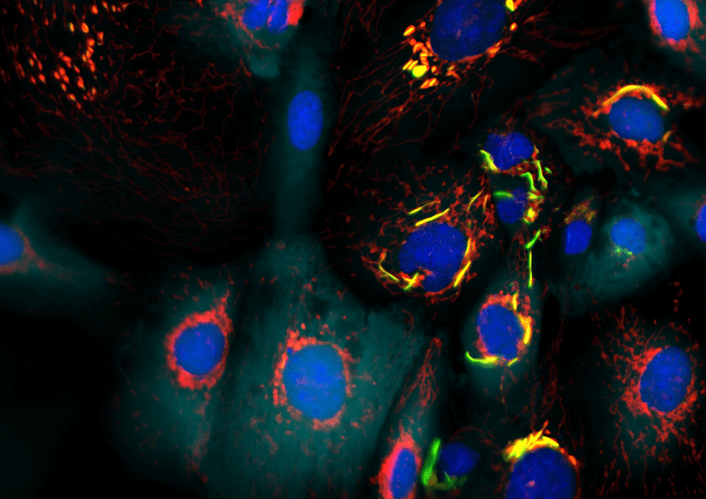
Células tumorais de câncer de próstata. Em vermelho, as mitocôndrias das células. Em verde, os feixes de filamentos da enzima glutaminase. Em ciano o citoplasma da célula, e em azul escuro o DNA nuclear. A coloração amarela se dá pela sobreposição de verde e vermelho, onde estão os filamentos de glutaminase (imagem: CNPEM/divulgação)
Agência FAPESP – Estudo conduzido no Centro Nacional de Pesquisa em Energia e Materiais (CNPEM) e no Instituto de Física de São Carlos da Universidade de São Paulo (USP) foi selecionado pelos editores da revista Nature Structural and Molecular Biology (NSBM) como um dos mais importantes já publicados.
Intitulado “Molecular mechanism of glutaminase activation through filamentation and the role of filaments in mitophagy protection”, o estudo recebeu financiamento da FAPESP por meio de seis projetos (20/06062-1, 17/15340-2, 21/01504-9, 17/11766-5, 14/20673-2 e 19/16351-3). No artigo, os autores descrevem um processo novo de bloqueio de mitofagia, que é a degradação seletiva das mitocôndrias por autofagia.
“Nós descobrimos que uma enzima – que se pensava estar envolvida somente no metabolismo de um aminoácido [glutamina] – de fato é capaz de se organizar como filamentos longos dentro da mitocôndria. Esse tipo de comportamento nunca havia sido descrito para nenhuma proteína dentro da mitocôndria. Nós também mostramos que esses filamentos distorcem as mitocôndrias, alongando-as, e isso impede que elas sejam ‘cortadas’ e recicladas”, explica à Agência FAPESP Sandra Martha Gomes Dias, pesquisadora do CNPEM e uma das autoras do artigo, publicado em 2023.
A pesquisa utilizou uma técnica conhecida como criomicroscopia eletrônica de partículas únicas para conhecer os detalhes moleculares desses filamentos, como se formam e o impacto disso para a função da enzima.
“Utilizamos também uma técnica de fronteira chamada de criotomografia eletrônica de lamelas celulares para provar a existência desses filamentos dentro da mitocôndria. É a primeira estrutura de proteína caracterizada por essa técnica em uma publicação brasileira”, acrescenta a pesquisadora.
No texto comemorativo dos 30 anos da Nature Structural and Molecular Biology, os editores explicam os motivos de escolha de cada artigo: “A editora, além de explicar nossos achados, chama a atenção para um ponto considerado importante para o campo da biologia estrutural do futuro: a busca de mecanismos moleculares, sem perder o contexto celular”, conta Dias.
Segundo Dias, até então, a biologia estrutural se preocupou em descrever proteínas em nível atômico e tem trazido respostas importantes sobre como essas moléculas funcionam e como alterações no seu funcionamento estão atreladas a várias doenças. “A tendência agora é compreender as proteínas nesse alto nível de detalhamento, mas dentro da célula considerando o local onde está [a organela] e as proteínas da vizinhança. Nosso trabalho fez a análise molecular da enzima filamentada, mas se preocupou em analisar ela no contexto celular [na mitocôndria], procurando explicar o impacto daqueles achados, de maneira direta, para o funcionamento da célula”, destaca.
O artigo comemorativo dos 30 anos da revista pode ser acessado em www.nature.com/articles/s41594-024-01248-z.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





