

A metalotioneína humana é a responsável por regular no organismo a concentração de elementos como ferro, zinco e cobre – além de eliminar metais pesados. Cientistas da USP e colaboradores chineses descobriram que sua estrutura microscópica é quase “líquida” (ilustração: acervo dos pesquisadores)
A metalotioneína humana é a responsável por regular no organismo a concentração de elementos como ferro, zinco e cobre – além de eliminar metais pesados. Cientistas da USP e colaboradores chineses descobriram que sua estrutura microscópica é quase “líquida”
A metalotioneína humana é a responsável por regular no organismo a concentração de elementos como ferro, zinco e cobre – além de eliminar metais pesados. Cientistas da USP e colaboradores chineses descobriram que sua estrutura microscópica é quase “líquida”
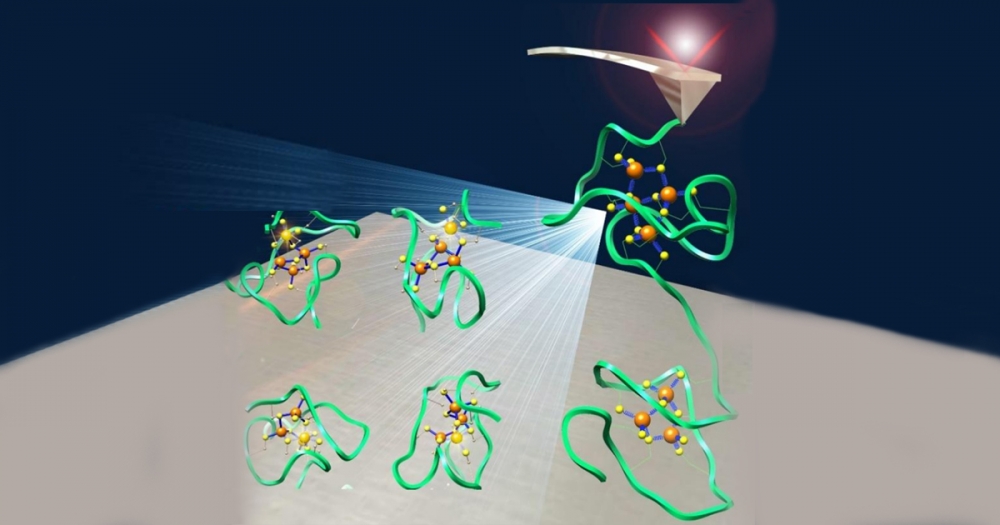
A metalotioneína humana é a responsável por regular no organismo a concentração de elementos como ferro, zinco e cobre – além de eliminar metais pesados. Cientistas da USP e colaboradores chineses descobriram que sua estrutura microscópica é quase “líquida” (ilustração: acervo dos pesquisadores)
Agência FAPESP* – Pesquisadores do Instituto de Química da Universidade de São Paulo (IQ-USP) e colaboradores da Universidade de Nanjing (China) detalharam pela primeira vez o funcionamento da metalotioneína humana, uma proteína responsável por controlar a concentração de metais no organismo. O estudo mostrou como a molécula atua para “capturar” moléculas de zinco, cobre, ferro e até mesmo de metais pesados, como mercúrio, impedindo que esses elementos vaguem livres pelo organismo e causem doenças.
Publicado na revista Research, o trabalho teve financiamento da FAPESP por meio do Programa São Paulo Researchers in International Collaboration (SPRINT). Os cientistas uniram técnicas de microscopia de força atômica e simulações moleculares por supercomputação para identificar como as ligações entre a proteína e os metais são estabelecidas e quebradas.
Como descrevem os autores no artigo, a metalotioneína é altamente dinâmica, quase “líquida”, pois não apresenta uma estrutura fixa e muda constantemente de acordo com as ligações químicas com os metais, que são de baixa estabilidade, quebram e se reformam facilmente.
“Materiais contendo metais são duros e estáveis do ponto de vista macroscópico, mas microscopicamente mostramos que podem ser extremamente flexíveis. A metalotioneína seria o mais próximo que existe no mundo biológico de algo como o personagem de metal líquido do filme Exterminador do Futuro 2, por exemplo”, afirma Guilherme Menegon Arantes, um dos coordenadores do estudo, em entrevista à Assessoria de Comunicação do IQ-USP.
O pesquisador explica que a metalotioneína ajuda a regular a concentração dos metais no organismo, mantendo uma condição de equilíbrio (homeostase). Quando estão livres no corpo, os metais, até mesmo os naturais e essenciais, podem se tornar tóxicos, causando reações danosas nas células. “Nós mostramos que a proteína é capaz de encapsular os metais, evitando que causem reações adversas”, diz Arantes.
No entanto, alguns metais que desempenham funções importantes, como o ferro e o zinco, precisam ser utilizados por outras proteínas. “Por isso, as ligações são frágeis: para que a metalotioneína possa transportar e liberar os metais no momento certo para exercerem as suas atividades”, completa.
Metais como zinco, cobre e ferro já foram relacionados por outros estudos a doenças neurodegenerativas. Isso porque os metais livres nos neurônios podem se ligar a proteínas-chave, impedindo-as de realizarem as suas funções corretamente.
Outro problema decorrente de metais livres envolve o metabolismo energético. Os metais pesados podem atrapalhar o funcionamento da mitocôndria, organela responsável por gerar energia para os processos metabólicos. “A presença desses metais aumenta a produção de radicais livres, que podem fazer reações em cadeia, não controladas, e lesar as células”, comenta o professor.
Os pesquisadores também descobriram que a proteína é capaz de se ligar a dezenas de metais diferentes, desde metais naturais essenciais para o organismo, como zinco, a metais pesados e tóxicos, como cádmio e mercúrio. Essas características foram observadas pelos pesquisadores chineses por meio da microscopia de força atômica, uma tecnologia que permite manipular uma única molécula com resolução atômica e verificar as suas propriedades mecânicas e físico-químicas.
O artigo Highly Dynamic Polynuclear Metal Cluster Revealed in a Single Metallothionein Molecule pode ser lido em: https://spj.sciencemag.org/journals/research/2021/9756945/.
* Com informações da Assessoria de Comunicação do IQ-USP.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





