

Según un estudio realizado en Brasil con ratones, este fenómeno puede estar relacionado con la deficiencia de una proteína llamada mitofusina 2 en el óvulo materno, que tiene efectos sobre la forma y sobre el funcionamiento de las mitocondrias (imagen: un óvulo con déficit de mitofusina 2 . Las manchas en verde representan a las mitocondrias en cantidad reducida, agrupadas e hinchadas con relación a los óvulos de control/Marcos Chiaratti)
Según un estudio realizado en Brasil con ratones, este fenómeno puede estar relacionado con la deficiencia de una proteína llamada mitofusina 2 en el óvulo materno, que tiene efectos sobre la forma y sobre el funcionamiento de las mitocondrias
Según un estudio realizado en Brasil con ratones, este fenómeno puede estar relacionado con la deficiencia de una proteína llamada mitofusina 2 en el óvulo materno, que tiene efectos sobre la forma y sobre el funcionamiento de las mitocondrias
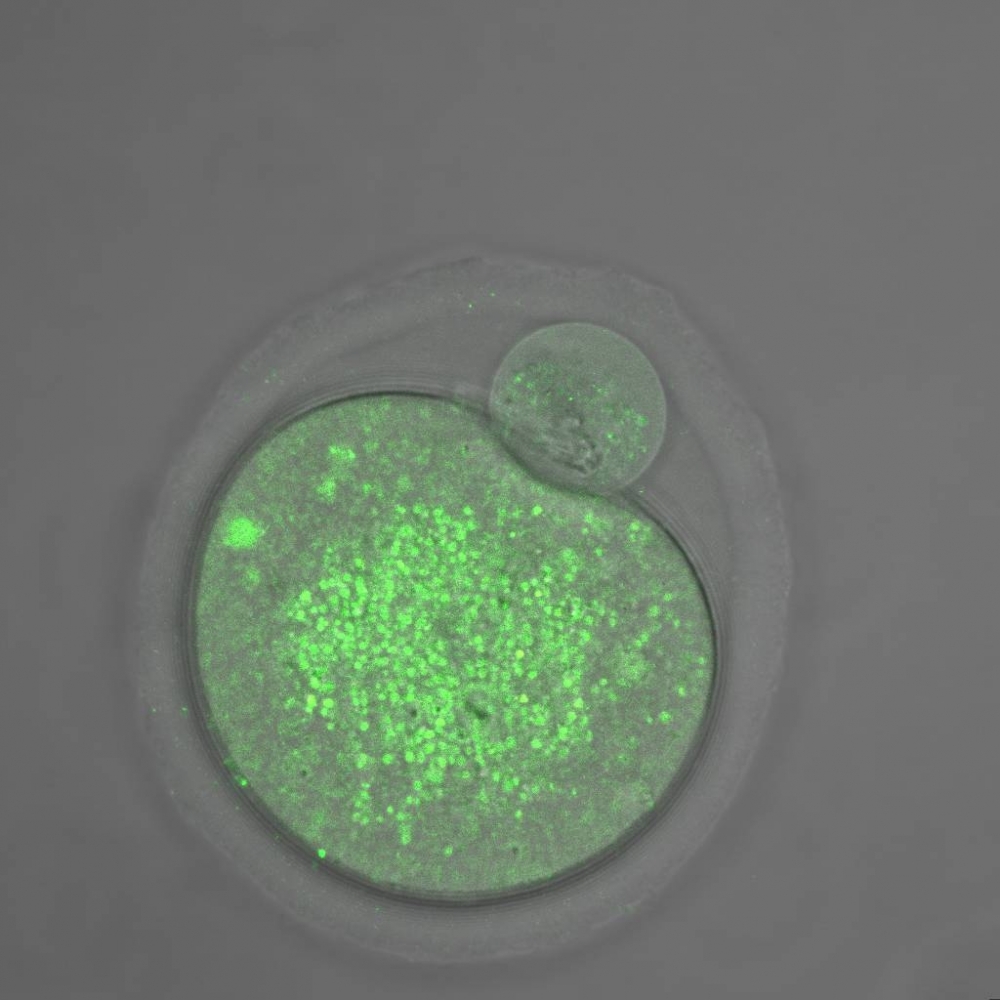
Según un estudio realizado en Brasil con ratones, este fenómeno puede estar relacionado con la deficiencia de una proteína llamada mitofusina 2 en el óvulo materno, que tiene efectos sobre la forma y sobre el funcionamiento de las mitocondrias (imagen: un óvulo con déficit de mitofusina 2 . Las manchas en verde representan a las mitocondrias en cantidad reducida, agrupadas e hinchadas con relación a los óvulos de control/Marcos Chiaratti)
Por Karina Toledo | Agência FAPESP – Un estudio brasileño publicado en la revista Molecular Human Reproduction ayuda a entender por qué los hijos de madres obesas son más propensos a desarrollar enfermedades metabólicas en el transcurso de sus vidas, tal como investigaciones anteriores ya lo habían sugerido.
Según los autores, este fenómeno de “transmisión transgeneracional de enfermedades” puede estar relacionado con la deficiencia de una proteína denominada mitofusina 2 en el óvulo materno. Normalmente, esta molécula está presente en la membrana externa de las mitocondrias. Su ausencia hace que esos orgánulos encargados del suministro de energía a las células se hinchen y se vuelvan disfuncionales, aparte de alterar la expresión de casi mil genes en el gameto femenino.
“La mitofusina 2 ha venido siendo señalada en diversos estudios como un importante regulador metabólico. Existen evidencias de que a medida que un individuo va aumentando de peso, la expresión de esta proteína disminuye en las células musculares y del hígado, dos tejidos importantes para la regulación de los niveles de glucemia. Y la expresión de mitofusina 2 también se encuentra en niveles reducidos en esas células en los portadores de diabetes”, comenta Marcos Chiaratti, docente del Departamento de Genética y Evolución de la Universidad Federal de São Carlos (UFSCar) y coordinador de la investigación, apoyada por la FAPESP.
En el artículo recientemente publicado, el grupo encabezado por Chiaratti describe los resultados de experimentos realizados con ratones genéticamente modificados para no expresar la mitofusina 2 únicamente en el gameto femenino (una célula también denominada ovocito u óvulo). Si bien la deficiencia de esta proteína generó efectos en lo que hace a la fertilidad de las hembras, tal como se imaginaba inicialmente, las crías generadas por estas experimentaron un mayor aumento de peso en comparación con las crías descendientes de las hembras de control y, al cabo de nueve semanas de vida, aun cuando se las había alimentado con una dieta estándar, se habían vuelto diabéticas.
Para develar los mecanismos moleculares asociados a este fenotipo anormal, Chiaratti entabló una colaboración con integrantes del Centro de Investigación en Procesos Rédox en Biomedicina (Redoxoma) y del Centro de Investigaciones en Obesidad y Comorbilidades (OCRC) –dos Centros de Investigación, Innovación y Difusión (CEPIDs) financiados por la FAPESP. Una parte de este trabajo se llevó a cabo durante la maestría de Bruna Garcia en el Centro de Ciencias Biológicas y de la Salud (CCBS) de la UFSCar, bajo la dirección de tesis de Chiaratti.
El primer paso consistió en evaluar qué tipo de disfunción presentaba el óvulo con déficit de mitofusina 2 al alcanzar el estadio en el que se encuentra listo para ser fecundado. Los análisis revelaron que la cantidad de mitocondrias se encontraba reducida en esas células, como así también la cantidad de ATP (trifosfato de adenosina, la molécula utilizada como combustible celular) producida.
Los investigadores también notaron que las mitocondrias de los gametos estaban más agrupadas que lo normal, tenían el doble del tamaño esperado y aparecían más lejos del retículo endoplasmático, el orgánulo con el cual deben interactuar para importar calcio y otras sustancias importantes para su funcionamiento.
De acuerdo con Chiaratti, una de las funciones conocidas de la mitofusina 2 consiste en asegurarse de que las mitocondrias se mantengan en contacto con el retículo endoplasmático, una estructura que participa en la síntesis y el transporte de diversas sustancias dentro de las células. Los resultados de la investigación sugieren que el déficit de esta molécula compromete la interacción entre ambos tipos de orgánulos, con lo cual se perjudica la función de ambos en los gametos.
“Existen evidencias de que el fenómeno de transmisión transgeneracional de enfermedades como la diabetes está asociado a la disfunción mitocondrial y al estrés del retículo endoplasmático en el óvulo. Nuestros hallazgos corroboran esta hipótesis”, le dice el investigador a Agência FAPESP. “La carencia de la mitofusina 2 parece afectar a la biogénesis mitocondrial [por eso la cantidad de orgánulos es menor] y también a la capacidad de las mitocondrias para moverse a través del citoplasma y dar cuenta de la demanda energética de las células”, añade.
El siguiente paso consistió en caracterizar el transcriptoma [el conjunto de moléculas de ARN que los genes expresan] del óvulo sin mitofusina 2 y compararlo con el de control. Mediante una técnica de secuenciación de ARNs, los investigadores descubrieron que 517 genes aparecían con una expresión disminuida en los gametos del animal modificado y otros 426 genes estaban más activos en comparación con el control.
“Por eso nos dispusimos a observar a qué vías de señalización pertenecían esos genes expresados de manera diferenciada. Encontramos vías relacionadas con el funcionamiento del retículo endoplasmático y de las mitocondrias, aparte de vías asociadas a procesos endócrinos como la regulación de la glicemia”, comenta Chiaratti.
Alteraciones en la prole
Los análisis realizados con los animales descendientes de las hembras genéticamente modificadas se enfocaron en las células del músculo esquelético y del hígado. El objetivo consistía en entender por qué esos animales se habían vuelto diabéticos aun cuando se los alimentó con una dieta balanceada.
En los dos tipos celulares, no se observó la condición conocida con el nombre de estrés del retículo endoplasmático, caracterizada por la acumulación de proteínas en el interior de ese orgánulo que entorpece su funcionamiento. Tampoco se detectaron alteraciones mitocondriales en las células musculares. En tanto, las mitocondrias del hígado aparecían con una ligera disfuncionalidad.
Debido a que esta alteración no era la suficiente como para explicar el fenotipo hiperglucémico de la prole, el grupo decidió entonces estudiar en esos animales la señalización de la insulina, la hormona elaborada en el páncreas que permite la entrada de glucosa en las células y que contribuye así para reducir el nivel de azúcar en la sangre.
Al analizar las células pancreáticas, arribaron a la conclusión de que la producción de insulina se encontraba en niveles normales. Sin embargo, el nivel circulante de esta hormona aparecía disminuido y así también la señal que envía normalmente a las células musculares y hepáticas.
“En esos dos tejidos, la insulina provoca una modificación bioquímica en una proteína denominada AKT [proteína quinasa B]. La señal que envía la insulina hace que esa molécula sea fosforilada [el agregado de fosfato a la cadena proteica] y esto activa una cascada de reacciones bioquímicas en las células”, explica Chiaratti.
Por ende, los resultados de estos análisis sugieren que estaba llegando al músculo y al hígado de la prole una cantidad menor de insulina, aunque la cantidad de esta hormona producida en el páncreas aparecía en niveles normales. Esto planteó la hipótesis de que la insulina podría estar siendo degradada más rápido en el organismo de esos animales, algo que aún deberá confirmarse en estudios futuros.
Los próximos pasos
Para avanzar en la comprensión de los mecanismos moleculares que llevaron al mayor aumento de peso y a la hiperglucemia en las crías generadas a partir de los óvulos deficientes de mitofusina 2, los investigadores pretenden repetir el experimento con algunas modificaciones. Las hembras genéticamente modificadas se alimentarán con una dieta hipercalórica para exacerbar los efectos causados por el déficit de la proteína en la prole.
“También pretendemos investigar, en animales sin ninguna modificación genética, si la dieta hipercalórica por sí sola es capaz de hacer disminuir la expresión de mitofusina 2 y alterar la forma y el funcionamiento de las mitocondrias, como así también su interacción con el retículo”, adelanta Chiaratti.
Según el investigador, se espera que el conocimiento generado en el marco de estos estudios haga posible el desarrollo de estrategias tendientes a manipular la expresión de la mitofusina 2 en el contexto de la obesidad, con el objetivo de prevenir la transmisión transgeneracional de enfermedades metabólicas.
A juicio de Alicia Kowaltowski, docente del Instituto de Química de la Universidad de São Paulo (IQ-USP), integrante del Redoxoma y coautora del artículo, los resultados obtenidos hasta ahora demuestran que el tipo de dieta y el estado nutricional de un individuo tienen un impacto sobre la forma de las mitocondrias, uno de los factores que modelan el funcionamiento celular. Por ende, según la investigadora, las proteínas que regulan la forma de la mitocondria constituyen potenciales blancos terapéuticos que deben explorarse.
“Cabe remarcar que no hemos encontrado alteraciones significativas en las mitocondrias del tejido hepático, pese a que los animales eran diabéticos. Esto va al encuentro de otros estudios que apuntan que la resiliencia de la función mitocondrial en el hígado es alta. Creemos que, por tratarse de un órgano central para el metabolismo, han de existir mecanismos de protección. Cuando la disfunción mitocondrial aparece en el hígado es porque el síndrome metabólico ya se encuentra en una fase avanzada de desarrollo”, comenta Kowaltowski.
La infertilidad y la herencia materna
El estudio ahora publicado, financiado por la FAPESP en el marco de diversos proyectos (09/54035-4, 12/50231-6, 17/05899-2, 17/04372-0, 16/11935-9, 16/11942-5, 16/07868-4, 18/06119-3 e 10/51906-1), integra una línea de investigación cuyo objetivo consiste en entender de qué manera eventuales alteraciones en las mitocondrias, e incluso mutaciones en el ADN mitocondrial, están asociadas con la infertilidad y la transmisión de enfermedades entre generaciones.
“Estudios anteriores demostraron que disfunciones mitocondriales pueden comprometer la fertilidad de los óvulos. Para entender mejor este mecanismo, creamos dos modelos animales. En uno de ellos inhibimos la expresión de la proteína mitofusina 1 en el óvulo, y en el otro, inhibimos la mitofusina 2”, informa Chiaratti.
La deficiencia de mitofusina-1 dejó a las hembras infértiles, tal como se describe en un artículo publicado en The Faseb Journal.
“En el trabajo anterior demostramos que esa deleción alteró la expresión de 161 genes y tuvo efectos sobre varios procesos en el interior del óvulo, especialmente sobre el de la comunicación con las células del ovario. En tanto, en el caso de los animales con déficit de mitofusina 2, se observaron otras alteraciones en los óvulos y en la prole, pero no así un impacto sobre la fertilidad”, comenta. “Curiosamente, los efectos de la deleción de mitofusina 1 se morigeraron en los óvulos cuando se inhibió la mitofusina 2 simultáneamente, lo cual sugiere que la acción de la mitofusina 1 se concreta después de la de la mitofusina 2.”
Puede leerse el artículo intitulado Mice born to females with oocyte-specific deletion of mitofusin 2 have increased weight gain and impaired glucose homeostasis en el siguiente enlace: academic.oup.com/molehr/advance-article-abstract/doi/10.1093/molehr/gaaa071/5942688.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





