

O painel A mostra a distribuição normal de CD4 (em verde) e MHC-I (HLA, em vermelho) em linfócitos T. O painel B mostra a mudança na distribuição dessas duas proteínas em um linfócito T que também expressa a proteína Nef do HIV. (imagem: Estela A. Pereira e Luis L. P. da Silva/FMRP-USP
Pesquisas evidenciam a forma como a molécula Nef consegue ´burlar´ os mecanismos de defesa das células humanas e, assim, permitir que o HIV avance; pesquisadores da USP de Ribeirão Preto comentam em artigo de revista do grupo Nature os avanços nessa área
Pesquisas evidenciam a forma como a molécula Nef consegue ´burlar´ os mecanismos de defesa das células humanas e, assim, permitir que o HIV avance; pesquisadores da USP de Ribeirão Preto comentam em artigo de revista do grupo Nature os avanços nessa área
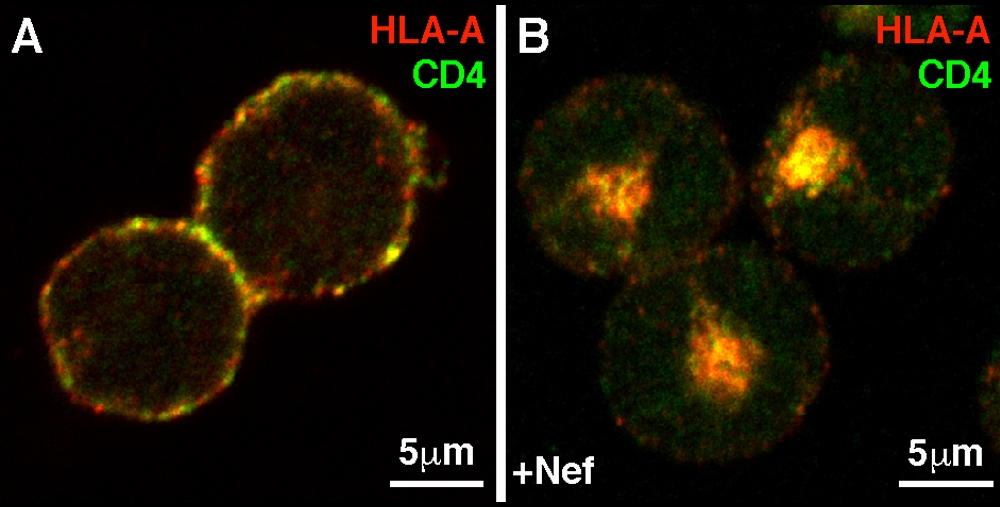
O painel A mostra a distribuição normal de CD4 (em verde) e MHC-I (HLA, em vermelho) em linfócitos T. O painel B mostra a mudança na distribuição dessas duas proteínas em um linfócito T que também expressa a proteína Nef do HIV. (imagem: Estela A. Pereira e Luis L. P. da Silva/FMRP-USP
Luciana Constantino | Agência FAPESP – A descoberta de um potencial "calcanhar de aquiles" da proteína Nef, crucial na virulência do HIV e em sua capacidade de desencadear a Aids, abre caminhos para a busca de uma nova classe de medicamentos contra o vírus. Pesquisadores conseguiram demonstrar uma estrutura que liga essa proteína a outra, chamada AP-2, e cuja função é regular a entrada na célula.
Com isso, está ficando cada vez mais clara a forma como Nef consegue “burlar” os mecanismos de defesa das células humanas e, assim, permitir que o HIV avance e reduza o tempo em que os sintomas da doença possam aparecer.
No artigo Hijacking of endocytosis by HIV-1 Nef is becoming crystal clear, publicado em agosto na Nature Structural & Molecular Biology (NSMB), o doutorando Yunan Januário e o professor Luis Lamberti Pinto da Silva, da Faculdade de Medicina de Ribeirão Preto (FMRP-USP), comentam a importância das recentes descobertas sobre essa proteína.
“Pesquisadores conseguiram obter a estrutura tridimensional entre Nef-CD4 e AP-2. Com isso, é possível ver as superfícies de contato, possibilitando outros estudos que gerem uma molécula para ocupar esse espaço e impeça o avanço dos efeitos da proteína. Essa 'fotografia' possibilita a busca de outras terapias anti-HIV”, explica Silva à Agência FAPESP.
Com mais de 15 anos de experiência na área, Silva foi convidado a comentar na publicação do grupo Nature o estudo Structural basis of CD4 downregulation by HIV-1 Nef, publicado na mesma edição da revista e cujo primeiro autor é a pesquisadora Yonghwa Kwon.
"Notavelmente, o estudo de Kwon e colaboradores mostra que Nef liga diretamente CD4 a AP-2. Também revela uma relação estrutural entre a regulação negativa de CD4 mediada por Nef e o antagonismo de Nef ao complexo principal de histocompatibilidade I (MHC-I)”, escrevem os dois brasileiros em seu artigo na NSMB.
Segundo Silva, já se sabe que Nef é fundamental para a progressão dos efeitos do HIV no desenvolvimento da Aids. Além disso, essa proteína pode continuar sendo produzida pelo organismo de pacientes em tratamento ou cujos níveis de vírus se mantenham abaixo dos detectáveis. "Isso tem sido relacionado com comorbidades da infecção. Nef é importante e não existe nenhuma droga para atacá-la”, completa o professor.
Ao longo dos últimos quase 40 anos, desde a descoberta do vírus da imunodeficiência humana como agente causador da Aids, as pesquisas vêm desvendando os intrincados mecanismos pelos quais o HIV ataca o sistema imunológico, invadindo e controlando as células. Mas até agora não foi possível bloquear diretamente a Nef, que já se mostrou uma proteína multifuncional e com intrincado sistema de funcionamento. Ela não faz parte da estrutura do HIV, mas modifica a célula para acomodar a replicação do vírus.
Atualmente, os medicamentos antirretrovirais, divididos em classes, agem no sistema imunológico do paciente, bloqueando as diferentes fases do ciclo de multiplicação do HIV, reduzindo a carga viral e até impedindo o desenvolvimento da doença.
Entre os antirretrovirais mais comuns estão, por exemplo, inibidores da transcriptase reversa (nucleosídeos e não nucleosídeos), que atuam nessa enzima para tornar defeituosa a cadeia de DNA que o vírus cria dentro da célula de defesa do organismo ou para bloquear diretamente sua multiplicação. Há também inibidores de protease e de integrase (proteína responsável pela integração do código genético do HIV ao da célula humana), além dos chamados inibidores de entrada, que bloqueiam receptores, como CCR5, e impedem o HIV de penetrar nas células de defesa.
A crescente resistência do HIV aos medicamentos atuais e os efeitos colaterais para pacientes, no entanto, têm feito com que cada vez mais se busquem novas formas de combater o vírus.
O Programa das Nações Unidas sobre HIV/Aids (Unaids) calcula que, em 2019, cerca de 38 milhões de pessoas viviam com o vírus em todo o mundo, dos quais 1,8 milhão de crianças com até 14 anos. Já o Ministério da Saúde estima que aproximadamente 866 mil brasileiros eram portadores do HIV no ano passado. Do total no mundo, 67% tinham acesso à terapia antirretroviral, segundo a Unaids.
Outras ligações
Por meio dos trabalhos com seu grupo de pesquisa na USP de Ribeirão Preto, Silva publicou no início do ano um estudo mostrando como Nef utiliza uma outra proteína celular, a AP-1G2, e o ponto entre essas duas vias. Esse trabalho teve o apoio da FAPESP.
Ao analisar os efeitos de Nef no sistema de endomembranas da célula hospedeira, o grupo descreveu os mecanismos pelos quais essa proteína utiliza uma outra, chamada AP-1G2, e manda o CD4 para os lisossomos – organelas com capacidade de degradar partículas –, retirando assim essas moléculas da superfície da célula. Essa ação de Nef facilita a saída de novos vírus da célula produtora, contribuindo para espalhar a infecção.
Isso porque o CD4 é o receptor usado pelo HIV para entrar na célula. Se ele permanece na superfície da célula produtora, esses novos vírus ficam presos e não se espalham tão facilmente. Por isso, Nef tira o CD4 da superfície da célula já infectada.
“Mostramos que há um ponto comum entre essas duas vias. Para mandar CD4 e MHC-I para o lisossomo, Nef sequestra uma terceira proteína da célula, comum às duas vias. Agora, com esse resultado, outros grupos podem mostrar a estrutura de Nef com a terceira proteína. Com isso, é possível obter um novo alvo, como foi feito com AP-2”, completa Silva.
Atualmente, o grupo de Silva trabalha em mais uma pesquisa, também com o apoio da FAPESP, cujo foco é descobrir novos alvos de Nef. “Vários ingredientes estão disponíveis. Agora tem de chegar alguém e costurar tudo isso para obter essa molécula capaz de inibir Nef”, conclui o pesquisador brasileiro.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





