

O gráfico (A) mostra que com a heparina ocorre alteração estrutural da proteína spike do SARS-CoV-2. Na imagem da proteína spike (B), a região em azul escuro representa o potencial domínio de ligação com o fármaco heparina (imagem: divulgação)
Testes em laboratório conduzidos por pesquisadores da Unifesp e colaboradores europeus revelam que a heparina modifica o formato da proteína usada pelo SARS-CoV-2 para entrar na célula hospedeira
Testes em laboratório conduzidos por pesquisadores da Unifesp e colaboradores europeus revelam que a heparina modifica o formato da proteína usada pelo SARS-CoV-2 para entrar na célula hospedeira
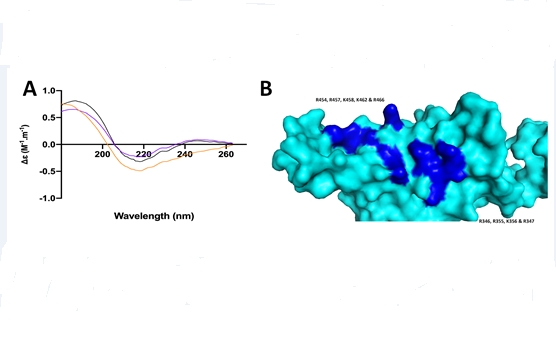
O gráfico (A) mostra que com a heparina ocorre alteração estrutural da proteína spike do SARS-CoV-2. Na imagem da proteína spike (B), a região em azul escuro representa o potencial domínio de ligação com o fármaco heparina (imagem: divulgação)
Elton Alisson | Agência FAPESP – Estudo conduzido por pesquisadores da Universidade Federal de São Paulo (Unifesp) e colaboradores europeus revela um possível novo mecanismo de ação do fármaco heparina no tratamento da COVID-19. Além de combater distúrbios de coagulação que podem afetar vasos do pulmão e prejudicar a oxigenação, o medicamento parece também ser capaz de dificultar a entrada do novo coronavírus (SARS-CoV-2) nas células.
Em testes de laboratório, feitos em linhagem celular proveniente do rim do macaco-verde africano (Cercopithecus aethiops), a heparina reduziu em 70% a invasão das células pelo novo coronavírus. Os resultados do estudo, apoiado pela FAPESP no âmbito de um projeto selecionado na chamada FAPESP “Suplementos de rápida implementação contra a COVID-19”, foram descritos em artigo publicado na plataforma bioRxiv, ainda em versão pré-print (sem revisão por pares). A pesquisa contou com a participação de cientistas da Inglaterra e da Itália.
“Existiam indícios de que a heparina, que é um fármaco que desempenha várias funções farmacológicas, também tinha capacidade de prevenir infecções virais, incluindo por coronavírus, mas as evidências não eram muito robustas. Conseguimos comprovar essa propriedade do medicamento em ensaios in vitro”, diz à Agência FAPESP Helena Bonciani Nader, professora da Unifesp e coordenadora do projeto do lado brasileiro.
O grupo de Nader estuda há mais de 40 anos os glicosaminoglicanos – classe de carboidratos complexos à qual a heparina pertence – e desenvolveu as primeiras heparinas de baixo peso molecular, usadas clinicamente como agentes anticoagulantes e antitrombóticos, inclusive em pacientes com COVID-19.
Uma das descobertas feitas pelo grupo ao longo deste período foi que a heparina é um medicamento multialvo, pois além do seu efeito na prevenção da coagulação do sangue pode se ligar a diversas proteínas. Entre elas, fatores de crescimento e citocinas que se ligam a receptores específicos na superfície de células-alvo.
Nos últimos anos, estudos feitos por outros grupos sugeriram que as proteínas de superfície de outros coronavírus até então relatados poderiam se ligar a um glicosaminoglicano das células de mamíferos, chamado heparam sulfato, para infectá-las.
Com o surgimento do SARS-CoV-2, os pesquisadores da Unifesp, em colaboração com os colegas ingleses e italianos, tiveram a ideia de avaliar se a proteína de superfície do novo coronavírus responsável pela infecção das células – chamada proteína spike – se liga à heparina, uma vez que a molécula do fármaco tem estrutura muito semelhante à do heparam sulfato.
Os experimentos confirmaram a hipótese. Por meio de técnicas de ressonância plasmônica de superfície e de espectroscopia de dicroísmo circular, observou-se que a heparina, ao se ligar às proteínas spike do SARS-CoV-2, causa nessas moléculas uma alteração conformacional. Dessa forma, avaria a “fechadura” para entrada do vírus nas células.
“Se não entrar na célula, o vírus não consegue se multiplicar e não tem sucesso na infecção”, explica Nader.
Melhor forma estrutural
Os pesquisadores também avaliaram quais formas estruturais da heparina apresentam melhor interação e são capazes de mudar a conformação das proteínas spike do novo coronavírus, com base em uma biblioteca de derivados e em diferentes fragmentos da molécula, definidos por tamanho.
“Os resultados das análises indicaram que a heparina que apresenta a melhor interação e atividade de alteração conformacional da proteína spike do SARS-CoV-2 é com oito polissacarídeos, ou seja, um octossacarídeo”, afirma Nader.
Os pesquisadores estão fazendo, agora, mudanças estruturais em heparinas para identificar uma molécula que apresente o mesmo efeito de ligação e mudança conformacional da proteína spike do novo coronavírus, mas que cause menos sangramento – um potencial efeito colateral do fármaco.
Além disso, também estão testando outros compostos chamados de heparinas miméticas – que mimetizam a ação da heparina.
“A ideia é chegar a uma molécula com melhor efeito antiviral”, afirma Nader, que também integra o Conselho Superior da FAPESP.
Segundo a pesquisadora, os estudos em andamento serão feitos com tecnologias de biologia estrutural que envolvem técnicas de ressonância nuclear magnética, de cinética de interação rápida por stop-flow, microscopia confocal e citometria de fluxo, entre outras, empregando diferentes modelos celulares.
O artigo Heparin inhibitis cellular invasion by SARS-CoV-2: structural dependence of the interaction of the surface protein (spike) S1 receptor binding domain with heparin (DOI: 10.1101/2020.04.28.066761), de Courtney J. Mycroft-West, Dunhao Su, Isabel Pagani, Timothy R. Rudd, Stefano Elli, Scott E. Guimond, Gavin Miller, Maria C. Z. Meneghetti, Helena B. Nader, Yong Li, Quentin M. Nunes, Patricia Procter, Nicasio Mancini, Massimo Clementi, Nicholas R. Forsyth, Jeremy E. Turnbull, Marco Guerrini, David G. Fernig, Elisa Vicenzi, Edwin A. Yates, Marcelo A. Lima e Mark A. Skidmore, pode ser lido no bioRxiv em www.biorxiv.org/content/10.1101/2020.04.28.066761v1.full.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





