


Grupo da Unifesp mostra que a mesma parte do sistema autônomo que controla respostas a situações de perigo ou estresse é capaz de reduzir a atividade das células que atacam potenciais ameaças ao organismo; descoberta possibilita novas abordagens terapêuticas contra distúrbios como a esclerose múltipla (imagem: Leandro Pires Araújo / Unifesp)
Grupo da Unifesp mostra que a mesma parte do sistema autônomo que controla respostas a situações de perigo ou estresse é capaz de reduzir a atividade das células que atacam potenciais ameaças ao organismo; descoberta possibilita novas abordagens terapêuticas contra distúrbios como a esclerose múltipla
Grupo da Unifesp mostra que a mesma parte do sistema autônomo que controla respostas a situações de perigo ou estresse é capaz de reduzir a atividade das células que atacam potenciais ameaças ao organismo; descoberta possibilita novas abordagens terapêuticas contra distúrbios como a esclerose múltipla
Grupo da Unifesp mostra que a mesma parte do sistema autônomo que controla respostas a situações de perigo ou estresse é capaz de reduzir a atividade das células que atacam potenciais ameaças ao organismo; descoberta possibilita novas abordagens terapêuticas contra distúrbios como a esclerose múltipla (imagem: Leandro Pires Araújo / Unifesp)
Janaína Simões | Agência FAPESP – Resultados de um estudo conduzido na Universidade Federal de São Paulo (Unifesp) sugerem que o sistema nervoso simpático – parte do sistema nervoso autônomo responsável por controlar respostas a situações de perigo ou estresse – pode modular a ação das células de defesa em portadores de doenças autoimunes.
Usando um modelo experimental de esclerose múltipla, os cientistas descobriram que o sistema nervoso simpático tem a capacidade de limitar a geração de uma resposta efetora, ou seja, de constranger a ação das células que atacam o antígeno considerado pelo sistema imune como uma ameaça.
A investigação foi coordenada por Alexandre Basso, professor do Departamento de Microbiologia, Imunologia e Parasitologia da Escola Paulista de Medicina, e contou com apoio da FAPESP. Os dados foram divulgados na revista Cell Reports.
“Nosso estudo abre uma oportunidade para o desenvolvimento de novas alternativas terapêuticas. O modelo que apresentamos, em tese, pode ser aplicado a outras doenças autoimunes, além da esclerose múltipla”, disse Basso à Agência FAPESP.
Segundo a Associação Brasileira de Esclerose Múltipla (Abem), mais de 35 mil brasileiros sofrem com a doença, que afeta mais mulheres do que homens, em geral na casa dos 20 aos 40 anos.
O artigo tem como autor principal Leandro Pires Araújo, também pesquisador do Departamento de Microbiologia, Imunologia e Parasitologia da Unifesp. A pesquisa recebeu financiamento da FAPESP por meio de um Auxílio Regular; um Apoio a Jovens Pesquisadores e uma Bolsa de Doutorado.
Estudos contraditórios
O modelo mais usado no estudo de doenças como a esclerose múltipla é conhecido como encefalomielite autoimune experimental e consiste em induzir uma inflamação no sistema nervoso central de animais por meio de imunização com antígenos oriundos da mielina, substância lipídica que recobre as fibras nervosas e auxilia na transmissão dos impulsos elétricos. A técnica pode ser aplicada em diferentes animais, dependendo da necessidade.
No caso da esclerose múltipla, o ataque das células de defesa a esses antígenos causa a desmielinização (perda de mielina) das fibras nervosas, prejudicando a comunicação entre os neurônios. A alteração na transmissão dos impulsos elétricos resulta em problemas como fraqueza muscular, alteração do equilíbrio e da coordenação motora e dores articulares.
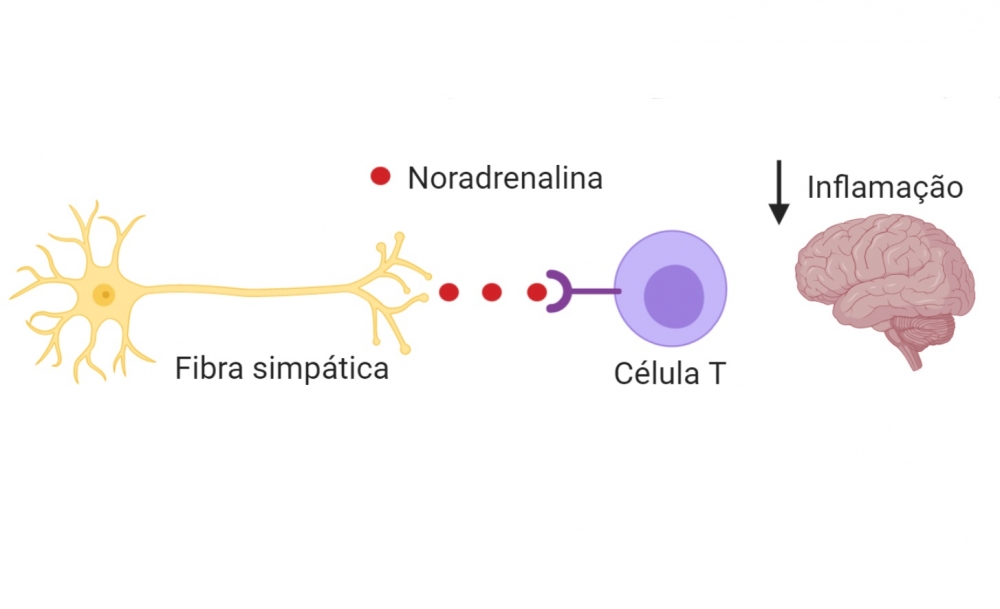
Em pesquisas já feitas com esse modelo, os animais foram tratados com a substância 6-hidroxidopamina (6-OHDA) para estudar a influência do sistema nervoso simpático sobre a doença autoimune. A droga elimina as fibras do sistema nervoso simpático que liberam noradrenalina, um dos neurotransmissores que controlam movimentos involuntários. Com a ausência dessas fibras, impede-se a liberação de noradrenalina nos órgãos que recebem a inervação do sistema nervoso simpático.
“A 6-hidroxidopamina entra na via de síntese da noradrenalina, ou seja, é captada por fibras nervosas simpáticas que expressam a tirosina hidroxilase, presente nos neurônios e nas células do sistema imune. Essa é uma enzima-chave na via de síntese da noradrenalina”, explicou Basso. “Os neurônios e células que expressam a tirosina hidroxilase também são capazes de captar, por meio de transportadores específicos, a 6-hidroxidopamina, que, por ser tóxica, acaba eliminando as células e as fibras do sistema nervoso simpático”, disse.
Os resultados das pesquisas com 6-OHDA são contraditórios. Alguns indicam que esse processo limitaria o desenvolvimento da doença autoimune, enquanto outros mostraram exatamente o contrário: na ausência das fibras, a doença se desenvolve de maneira mais grave.
Alguns dos estudos sinalizaram que o tratamento com 6-hidroxidopamina poderia eliminar células do sistema imune importantes para o desenvolvimento da doença. “A partir desse dado, formulamos a hipótese de que as contradições existentes na literatura a partir dos estudos que usaram a 6-OHDA talvez pudessem estar relacionadas ao fato de que algumas células do sistema imune, com as quais o sistema nervoso interage, também expressam a enzima tirosina hidroxilase e são capazes de sintetizar e secretar noradrenalina, sendo, portanto, alvos da 6-OHDA”, disse o pesquisador.
Modelo alternativo
O grupo de pesquisa de Basso propôs, então, outra estratégia experimental para estudar a influência do sistema nervoso simpático no desenvolvimento da doença autoimune: camundongos geneticamente modificados para se tornarem deficientes de alguns receptores adrenérgicos importantes no processo de controle da liberação de neurotransmissor pelas fibras do sistema nervoso simpático.
Como os animais não têm esses receptores, a liberação de noradrenalina é muito maior. “Usamos uma estratégia inversa: em vez de usar um modelo que eliminava as fibras [reduzindo a produção de noradrenalina], usamos um modelo em que o sistema nervoso simpático é hiperativo [e libera mais noradrenalina]”, contou.
“Após verificar que, de fato, os animais com hiperatividade do sistema nervoso simpático desenvolviam a doença de forma mais branda, com prejuízo na geração da resposta imune efetora [que visa destruir os antígenos de mielina], nos perguntamos de que modo a maior quantidade de noradrenalina liberada pelo sistema nervoso simpático desses animais poderia influenciar o desenvolvimento da doença”, disse.
Para verificar isso, os cientistas bloquearam farmacologicamente um dos receptores existentes nas células e que são ativados pela noradrenalina, o receptor ß2-adrenérgico. Após esse procedimento, os animais voltaram a desenvolver uma forma mais grave da doença quando comparados com o grupo de animais controle (com o sistema nervoso simpático hiperativo), confirmando a influência do sistema nervoso simpático no desenvolvimento da doença autoimune.
“Assim, verificamos que a maior quantidade de noradrenalina liberada pelo sistema nervoso simpático regula o desenvolvimento da doença por meio da maior ativação do receptor ß2-adrenérgico em células do sistema imune, em especial nos linfócitos T CD4+”, disse. Esse tipo de linfócito atua na ativação e na estimulação de outros leucócitos, de modo a orquestrar a resposta inflamatória no sistema nervoso central dos animais com encefalomielite.
O novo modelo já está sendo usado, na Unifesp, para estudar de que modo o sistema nervoso simpático influencia uma resposta alérgica pulmonar. Existem moléculas que acionam ou bloqueiam o receptor ß2-adrenérgico e são utilizadas em várias situações. “Uma deles, o fenoterol, é usada em asmáticos para que haja relaxamento das vias aéreas, de forma que os pacientes com broncoconstrição possam respirar mais facilmente. Qual a consequência do seu uso para a resposta imune? Nossa pesquisa levanta esse tipo de pergunta”, disse Basso.
O artigo The sympathetic nervous system mitigates CNS autoimmunity via ß2-adrenergic receptor signaling in immune cells, de Leandro Pires Araujo, Juliana Terzi Maricato, Marcia Grando Guereschi, Francisco J. Quintana, Patrícia C. Brum e Alexandre S. Basso, pode ser lido em www.cell.com/cell-reports/pdfExtended/S2211-1247(19)31090-3.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





