
Según un estudio del Centro de Investigación en Procesos Redox en Biomedicina, el llamado hierro lábil previene la oxidación al reaccionar con el peroxinitrito: un cambio de paradigma en varios procesos biológicos (ilustración: CEPID Redoxoma)
Según un estudio del Centro de Investigación en Procesos Redox en Biomedicina, el llamado hierro lábil previene la oxidación al reaccionar con el peroxinitrito: un cambio de paradigma en varios procesos biológicos
Según un estudio del Centro de Investigación en Procesos Redox en Biomedicina, el llamado hierro lábil previene la oxidación al reaccionar con el peroxinitrito: un cambio de paradigma en varios procesos biológicos

Según un estudio del Centro de Investigación en Procesos Redox en Biomedicina, el llamado hierro lábil previene la oxidación al reaccionar con el peroxinitrito: un cambio de paradigma en varios procesos biológicos (ilustración: CEPID Redoxoma)
Por Maria Fernanda Ziegler | Agência FAPESP – Durante muchos años los científicos consideraron que el llamado hierro lábil –un reservorio de hierro existente en las células humanas– era exclusivamente prooxidante. Este tipo de hierro generalmente se encuentra asociado a la producción del radical libre hidroxilo cuando reacciona con el peróxido de hidrógeno. El radical hidroxilo es un oxidante sumamente reactivo, probadamente perjudicial para importantes macromoléculas.
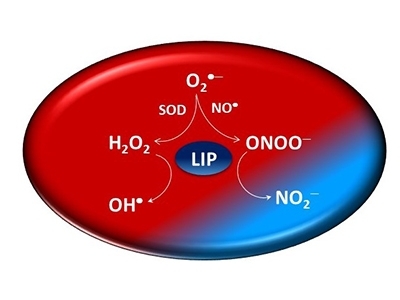
Un estudio realizado en el Centro de Investigación en Procesos Redox en Biomedicina (Redoxoma) –un Centro de Investigación, Innovación y Difusión (CEPID) que cuenta con el apoyo de la FAPESP– demostró que el hierro lábil también tiene acción antioxidante cuando reacciona con el peroxinitrito.
Además de ser un potente oxidante, el peroxinitrito da origen a otros radicales libres reactivos. Fisiológicamente, esto quiere decir que este tipo de hierro también combate a otras sustancias oxidantes.
“Hasta ahora se consideraba que el hierro lábil era un agente oxidante porque interactúa con el peróxido de hidrógeno y produce radicales libres que dañan a ciertas macromoléculas. Pero descubrimos que al interactuar con otro peróxido importante que es el peroxinitrito, ejerce un papel contrario al que se le atribuye normalmente y previene la oxidación. Como toda la literatura científica está relacionada con la acción oxidante de este tipo de hierro, creemos que este descubrimiento constituye un cambio de paradigma importante”, dijo José Carlos Toledo Junior, docente del Departamento de Química de la Facultad de Filosofía, Ciencias y Letras de Ribeirão Preto, de la Universidad de São Paulo (FFCLRP/USP), en Brasil, y uno de los autores de un artículo publicado en Journal of Biological Chemistry en el cual se consignan los resultados de esta investigación.
El descubrimiento del equipo del Redoxoma tiene impacto sobre el conocimiento de importantes procesos celulares, puesto que todas las células contienen y controlan el nivel de esta fuente de hierro.
Toledo explica que el peroxinitrito es un oxidante biológicamente relevante debido a que es producido por dos radicales libres –el óxido nítrico (NO) y superóxido–, a los cuales la mayoría de las células se encuentran normalmente expuestas.
“Todas las células humanas poseen hierro lábil y toda las células están expuestas al NO y al superóxido en algún momento. Por ende, el peroxinitrito es producido en las células fundamentalmente en casos de infección o inflamación, cuando las células del sistema inmunológico producen tanto NO como superóxido para combatir a los microorganismos y producir oxidantes”, declaró Toledo a Agência FAPESP.
“La acción antioxidante del hierro lábil altera algunos conceptos y puede tener impacto sobre procesos biológicos relacionados con el óxido nítrico, el peroxinitrito y el hierro lábil”, añadió el investigador.
En el estudio, los científicos investigaron la interacción entre el hierro lábil y el peroxinitrito en un cultivo celular de macrófagos. El grupo también realizó experimentos en un sistema no celular, en idénticas condiciones y empleando los mismos indicadores.
Con base en el empleo de quelantes –reactivos químicos que forman un complejo con hierro lábil y alteran sus propiedades–, el equipo logró “remover” el hierro lábil y verificó un aumento de la oxidación. Ésts se monitoreó mediante espectroscopía de fluorescencia con la ayuda de indicadores fluorescentes.
“Todo lo que hacíamos en el experimento apuntaba hacia un lado distinto a aquello que aparecía descrito en la literatura. Cuando observamos el aumento de la oxidación, cuando se removía el hierro, empezamos a sospechar que el hierro lábil podría también ser un antioxidante. Sostuvimos esa hipótesis y mostramos que es verdadera”, dijo Toledo.
Si bien la acción antioxidante contra el peroxinitrito nunca había sido considerada, de alguna manera era esperable, visto y considerando que los metales se encuentran entre los blancos de preferencia del peroxinitrito. “La reacción entre el hierro lábil y peroxinitrito se mostró cinéticamente competitiva. Lo interesante es que el producto de esta reacción no es oxidante”, dijo el investigador.
“Este descubrimiento permite el desarrollo de una nueva línea de investigación relacionada con la acción antioxidante del hierro lábil. Realizaremos estudios fundamentales sobre velocidad de las reacciones a los efectos de determinar si este tipo de hierro también reacciona con derivados radicalares del peroxinitrito, y teniendo en cuenta que las células poseen distintas cantidades de ese hierro, verificaremos si la acción antioxidante del mismo ante el óxido nítrico es proporcional a esa cantidad”, dijo Toledo.
Puede leerse el artículo intitulado The labile iron pool attenuates peroxynitrite-dependent damage and can no longer be considered solely a pro-oxidative cellular iron source (doi: 10.4172/2165-7025.1000394), de Fernando Cruvinel Damasceno, André Luis Condeles, Angélica Kodama Bueno Lopes, Rômulo Rodrigues Facci, Edlaine Linares, Daniela Ramos Truzzi, Ohara Augusto y Jose Carlos Toledo Jr., en el siguiente enlace: jbc.org/content/early/2018/04/16/jbc.RA117.000883.abstract?sid=afafc375-5a48-4a74-85c4-f6c96382e05e.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.





