
Parceria entre pesquisadores da USP e da Universidade de Aveiro permite aplicação de processo sustentável em escala industrial para a purificação de proteínas peguiladas (imagem: divulgação)
Parceria entre pesquisadores da USP e da Universidade de Aveiro permite aplicação de processo sustentável em escala industrial para a purificação de proteínas peguiladas
Parceria entre pesquisadores da USP e da Universidade de Aveiro permite aplicação de processo sustentável em escala industrial para a purificação de proteínas peguiladas

Parceria entre pesquisadores da USP e da Universidade de Aveiro permite aplicação de processo sustentável em escala industrial para a purificação de proteínas peguiladas (imagem: divulgação)
Maria Fernanda Ziegler | Agência FAPESP – Pesquisadores do Departamento de Bioquímica e Tecnologia Farmacêutica da Universidade de São Paulo (USP), em parceria com o Departamento de Química da Universidade de Aveiro, em Portugal, conseguiram desenvolver um método alternativo para a purificação de uma classe de medicamento biológico, as proteínas peguiladas.
O estudo, apoiado pela FAPESP, teve resultados publicados em matéria de capa da revista Green Chemistry.
No artigo, a equipe descreve um processo inovador e sustentável de purificação de proteínas modificadas, baseado em sistemas aquosos bifásicos. Essas plataformas de purificação utilizam água como solvente, apresentando elevada compatibilidade com as proteínas, baixo custo e fácil escalonamento do processo.
A modificação de proteínas consiste na peguilação química, ou seja, a ligação covalente de polietilenoglicol à proteína. A peguilação é uma das principais técnicas empregadas atualmente para obtenção de biofármacos – e suas versões melhoradas, os biobetters. Entre os exemplos de proteínas peguiladas estão biofármacos aplicados para o tratamento de doenças como imunodeficiência combinada grave ou leucemia linfoide aguda.
No artigo, a equipe de pesquisadores propõe a peguilação de uma proteína que pode ser utilizada como biossensor. O estudo visa melhorar a estabilidade da proteína por meio da peguilação e aumentar a eficácia da mesma para a sua aplicação como biossensor.
“A peguilação se tornou um processo muito importante na indústria farmacêutica para o melhoramento de biofármacos, tanto que tem aumentado muito o número de medicamentos biológicos que são proteínas peguiladas. Porém, existem desafios na peguilação e a purificação talvez seja o principal deles. Este processo corresponde a cerca de 80% do custo total do fármaco”, disse Carlota Rangel Yagui, orientadora do estudo e uma das autoras do artigo.
Industrialmente, as proteínas peguiladas são purificadas pelo método de cromatografia. No entanto, esse processo apresenta desvantagens, como o elevado custo e por não permitir a reciclagem das proteínas não peguiladas para um novo processo de peguilação, o que tornaria o processo mais sustentável e rentável.
“Conseguimos realizar a purificação das moléculas em três etapas, em um processo mais sustentável e econômico que o cromatográfico. Os sistemas aquosos bifásicos, compostos somente por água e outras duas substâncias, como um polímero ou um sal, já são usados na purificação de outras substâncias e se mostraram altamente eficientes para as proteínas peguiladas ”, disse Yagui.
Citocromo c, aplicação como biossensor
O estudo foi realizado em moléculas de citocromo c, proteína capaz de catalisar processos oxidativos e que pode ser empregada como dispositivo analítico que detecta alterações em amostras (biossensor). Porém, a expectativa dos pesquisadores é que o processo alternativo de purificação possa ser adaptado para outras proteínas peguiladas.
“Biossensores são moléculas de interesse industrial, não só para a indústria farmacêutica, mas também para a de alimentos e a agroindústria”, disse Yagui.
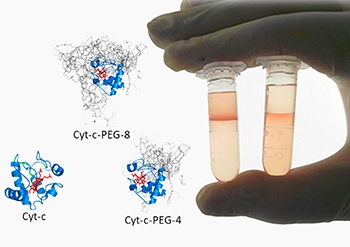
No trabalho, as proteínas purificadas por sistemas aquosos bifásicos foram fracionadas em diferentes formas de citocromos c peguilados e também separadas das proteínas que não reagiram.
“Conseguimos peguilar o citocromo c com quatro moléculas de PEG e também com oito. Nenhum trabalho conseguia simultaneamente separar formas específicas peguiladas e fazer o reciclo da proteína nativa para um novo processo de peguilação”, disse João Santos, aluno de duplo doutorado na USP e na Universidade de Aveiro e primeiro autor do artigo.
A descoberta de uma alternativa sustentável para a purificação de proteína peguilada desencadeou outras frentes de trabalho para o grupo de pesquisadores: a ampliação de escala da técnica alternativa e o uso do citocromo c peguilado como biossensor em ensaios de eletroquímica.
“Em nosso artigo, propusemos o citocromo c como um biossensor e agora queremos estudar se ele consegue ter uma vida útil maior com a peguilação”, disse Yagui. Biossensores enzimáticos costumam ter duração limitada devido a desnaturação por variação de temperatura e pH e exposição ao material dos eletrodos empregados.
Santos concluiu o estudo de escalonamento industrial da purificação do citocromo c peguilado por sistemas aquosos bifásicos utilizando a técnica de CPC (cromatografia por partição centrífuga) e resultados do trabalho serão publicados em artigo ainda este ano.
O artigo Multistep purification of cytochrome c PEGylated forms using polymer-based aqueous biphasic systems (doi: 10.1111/1462-2920.14085), de João H. P. M. Santos, Gustavo Carretero, João A. P. Coutinho, Carlota O. Rangel-Yagui e Sónia P. M. Ventura, pode ser lido na Green Chemistry em http://pubs.rsc.org/en/content/articlelanding/2017/gc/c7gc02600e#!divAbstract.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





