
Mediante simulaciones computacionales, científicos investigan de qué manera interactúan la cinasa AAK1 y la pequeña molécula capaz de inhibir su actividad
Una colaboración entre la Universidad de Campinas y el laboratorio Aché resulta en un artículo donde se describe un compuesto químico capaz de inhibir selectivamente a la enzima cinasa AAK1
Una colaboración entre la Universidad de Campinas y el laboratorio Aché resulta en un artículo donde se describe un compuesto químico capaz de inhibir selectivamente a la enzima cinasa AAK1

Mediante simulaciones computacionales, científicos investigan de qué manera interactúan la cinasa AAK1 y la pequeña molécula capaz de inhibir su actividad
Por Karina Toledo | Agência FAPESP – Se dio a conocer recientemente en la plataforma abierta bioRxiv uno de los primeros frutos de la colaboración entablada entre el Centro de Biología Química de Proteínas Cinasas de la Universidad de Campinas (SGC-Unicamp), en São Paulo, Brasil, y Aché Laboratórios Farmacêuticos, un trabajo que contó con el apoyo de la FAPESP.
En ese estudio se describe un compuesto químico que podrá utilizarse en futuras investigaciones como inhibidor selectivo de la enzima AAK1 (proteína cinasa 1 asociada a la AP2), considerada un potencial blanco para el desarrollo de fármacos.
El centro de la Unicamp, vinculado al Structural Genomics Consortium (SGC) –una alianza público-privada que reúne en diversos países a más de 400 científicos de universidades, industrias farmacéuticas y entidades sin fines de lucro–, y encabezado por los investigadores Jonathan Elkins, Katlin Massirer Opher Gileadi y Paulo Arruda, tiene el objetivo de develar la función de proteínas del tipo de las cinasas, encargadas de regular procesos importantes del organismo, tales como la división, la proliferación y la diferenciación celular. Aunque se las considera blancos prioritarios para el desarrollo de fármacos, se estima que sólo 40 de las alrededor de 500 proteínas de este tipo identificadas y existentes en el genoma humano han sido estudiadas como es debido.
De acuerdo con Rafael Couñago, investigador del SGC-Unicamp y primer autor del artículo, la AAK1 es una cinasa implicada en el proceso de endocitosis, mediante el cual diversos tipos de partículas del medio extracelular –tales como neurotransmisores, micronutrientes e incluso algunos virus (los de la hepatitis, del dengue y del Zika, por ejemplo)– son transportados hacia el interior de las células.
“Existen evidencias en la literatura científica que indican que, cuando se inhibe la acción de la AAK1, la endocitosis ocurre con menor frecuencia. Pero, para entender su función exacta en la célula y verificar si constituye efectivamente un blanco terapéutico prometedor, necesitamos contar con un tipo de herramienta conocido como sonda química, que es una pequeña molécula capaz de unirse selectivamente a esa enzima e inhibir su función en un modelo biológico”, comentó Couñago.
Tal como explicó el investigador, ya se sabe que la AAK1 se encarga de la fosforilación de la proteína AP2 (proteína adaptadora 2) o, en otras palabras, de catalizar la transferencia de un grupo fosfato de moléculas de alta energía como el ATP (trisfosfato de adenosina) a la AP2, y esto modifica la actividad de la proteína blanco en la célula, con lo cual el proceso de endocitosis ocurre con mayor frecuencia.
“Aún es necesario detallar mejor cómo sucede esta regulación. Hay que descubrir en qué momento del proceso de endocitosis es importante la acción de la AAK1, por ejemplo”, afirmó.
Selección
En busca de una sonda química que permita estudiar a la AAK1, científicos del centro del SGC, con sede en la Universidad de Carolina del Norte en Chapel Hill, Estados Unidos, cribaron una biblioteca de moléculas químicas mediante un método conocido como high-throughput screening (cribado automatizado a gran escala), un tipo de ensayo bioquímico en el cual se pone a la enzima a interactuar con centenas de posibles inhibidores simultáneamente. La compañía farmacéutica GSK, una de las socias del consorcio, cedió la colección de compuestos.
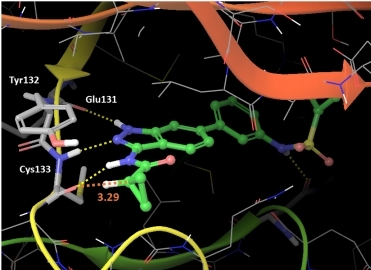
En el centro del SGC en la Unicamp, los investigadores dilucidaron la estructura tridimensional del complejo formado por la molécula que se mostró más prometedora en los ensayos a gran escala y la proteína cinasa más parecida a la AAK1 en humanos –denominada BIKE– mediante un método conocido como cristalografía de rayos X.
“La estructura cristalográfica revela cómo transcurre el contacto íntimo entre la pequeña molécula y la proteína. Y nos permite detectar qué parte de la sonda química es responsable de la gran afinidad que ésta demuestra con respecto a la AAK1”, explicó Couñago.
Con la colaboración del equipo de innovación radical de Aché, encabezado por el director, Cristiano Guimarães, se realizaron estudios computacionales destinados a calcular el costo energético durante la estabilización del proceso catalítico.
“Este análisis nos demostró que cuando reemplazamos un grupo ciclopropilo por un isopropilo en la estructura de la pequeña molécula candidata a sonda, su actividad disminuye drásticamente. Sucede que el costo energético para formar el complejo se vuelve mucho mayor, cosa que no puede detectarse únicamente observando la estructura”, explicó Couñago.
Este descubrimiento es importante, ya que hace posible, según el investigador, que esa versión alternativa de la pequeña molécula con el grupo isopropilo sea utilizada como un “control negativo” en los experimentos. Sucede que, aunque se desconecta la interacción con la AAK1, la candidata a sonda sigue interactuando normalmente con todas las otras proteínas de la célula.
“Entonces podemos hacer los mismos experimentos utilizando la sonda química y valiéndonos del control negativo, y luego comparar los resultados. De esta forma, aumentamos el grado de certidumbre de que los efectos biológicos observados con el inhibidor son producto de la inhibición de la función de la AAK1”, dijo el investigador.
Open Science
Uno de los principios claves del modelo de colaboración del SGC es el de “ciencia abierta”, es decir: todos los participantes del consorcio se comprometen a hacer públicos los resultados de sus investigaciones lo más pronto posible. Por ese motivo, según explicó Couñago, el artículo quedó disponible en internet incluso antes de que se lo sometiera al proceso de revisión por pares.
“Creemos que de este modo aumentamos la cantidad de gente que puede comentar el trabajo, para que así podamos efectuar las debidas correcciones e incrementar entonces el impacto de los descubrimientos”, sostuvo.
Para el investigador, si bien la pequeña molécula ha demostrado que cuenta con potencial como para convertirse en una sonda química, aún se hacen necesarios más estudios de control de calidad.
“Ahora estamos en la etapa de captar colaboradores interesados en estudiar la vía de la endocitosis y la función de la AAK1 en este proceso. El SGC no tiene la capacidad como para trabajar con modelos biológicos variados; por ese motivo, procura llegar a la comunidad científica lo más pronto posible, con miras a atraer colaboraciones”, concluyó Couñago.
Puede leerse el artículo intitulado “Development of Narrow Spectrum ATP-competitive Kinase Inhibitors las Probes for BIKE and AAK1” en el siguiente enlace: biorxiv.org/content/biorxiv/early/2016/12/15/094631.full.pdf.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.




