
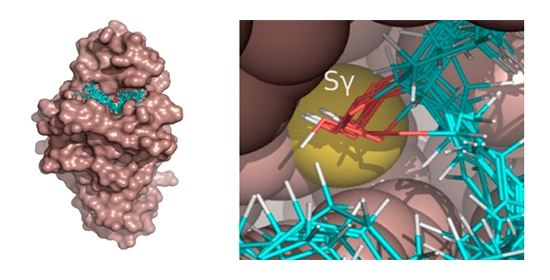
Em pesquisa publicada na PNAS, pesquisadores do Cepid Redoxoma identificaram substratos biológicos da enzima bacteriana Ohr, um potencial alvo para o desenvolvimento de novos fármacos (Figura: Docking molecular de hidroperóxidos de cadeia longa no sítio ativo da Ohr/Thiago G. P. Alegria, et al.)
Em pesquisa publicada na PNAS, pesquisadores do Cepid Redoxoma identificaram substratos biológicos da enzima bacteriana Ohr, um potencial alvo para o desenvolvimento de novos fármacos
Em pesquisa publicada na PNAS, pesquisadores do Cepid Redoxoma identificaram substratos biológicos da enzima bacteriana Ohr, um potencial alvo para o desenvolvimento de novos fármacos

Em pesquisa publicada na PNAS, pesquisadores do Cepid Redoxoma identificaram substratos biológicos da enzima bacteriana Ohr, um potencial alvo para o desenvolvimento de novos fármacos (Figura: Docking molecular de hidroperóxidos de cadeia longa no sítio ativo da Ohr/Thiago G. P. Alegria, et al.)
Karina Toledo | Agência FAPESP – Uma pesquisa apoiada pela FAPESP e conduzida na Universidade de São Paulo (USP) em colaboração com outras instituições de pesquisa nacionais e internacionais, revelou novos aspectos relacionados ao mecanismo de ação da enzima Ohr (proteína de resistência a hidroperóxidos orgânicos, na sigla em inglês), que confere a diversas espécies de bactérias a capacidade de neutralizar substâncias oxidantes liberadas pelo sistema de defesa do organismo hospedeiro – seja ele planta ou animal.
Os resultados foram divulgados recentemente na revista Proceedings of the National Academy of Sciences (PNAS). Segundo os autores, o conhecimento pode possibilitar novas abordagens terapêuticas.
“Não há em plantas ou em animais nenhuma proteína conhecida com estrutura semelhante à da Ohr. Isso sugere que é possível inibir essa enzima na bactéria sem causar grandes prejuízos ao organismo infectado e, por isso, ela se torna um alvo interessante para o desenvolvimento de fármacos”, afirmou o professor do Instituto de Biociências (IB-USP) Luis Eduardo Soares Netto, coordenador do estudo.
O pesquisador ressaltou, no entanto, que ainda faltam dados que relacionem a presença da Ohr com a virulência dos patógenos.
Diversos experimentos foram feitos pela equipe de Netto para entender como a Ohr participa da defesa antioxidante de bactérias, muitas delas patogênicas. Parte da investigação foi conduzida durante o mestrado de Thiago Alegria, o doutorado de José Renato Cussiol e o pós-doutorado de Diogo Meireles – todos bolsistas da FAPESP. Os projetos estão vinculados ao Centro de Pesquisa em Processos Redox em Biomedicina (Redoxoma), um dos Centros de Pesquisa, Inovação e Difusão (CEPIDs) apoiados pela Fundação.
“Quando começamos a pesquisa, já sabíamos que a Ohr tinha função antioxidante, mas não eram conhecidos os substratos fisiológicos dessa enzima. Nós mostramos neste estudo que ela neutraliza preferencialmente peróxidos – particularmente os hidroperóxidos de ácidos graxos de cadeia longa – e o peroxinitrito”, contou Netto.
Para chegar a essa conclusão, os pesquisadores fizeram inicialmente os chamados testes de ancoragem molecular (docking). Por simulação computacional foi possível ver o encaixe dos possíveis substratos ao sítio ativo da enzima. Essas análises mostraram grande complementariedade estrutural entre a Ohr e diferentes tipos de hidroperóxidos de ácidos graxos, como os derivados do ácido araquidônico e do ácido linoleico, substâncias que atuam como mediadores de processos inflamatórios em mamíferos e em plantas, respectivamente.
Para validar esse primeiro achado, foram feitos ensaios bioquímicos in vitro com a proteína Ohr produzida pela Xylella fastidiosa – bactéria causadora da doença clorose variegada dos citros (CVC) ou “amarelinho”, que ataca os citros. Conforme explicou Netto, o trabalho é um desdobramento do projeto realizado nos anos 1990, com apoio da FAPESP, para sequenciar o genoma da X. fastidiosa.
Nos testes in vitro, os cientistas incubaram a Ohr purificada com diversos tipos de hidroperóxidos. O objetivo foi medir o tempo necessário para a enzima transformar cada um desses oxidantes em substâncias menos tóxicas.
“Observamos, por exemplo, que ela consegue neutralizar o peróxido de hidrogênio [água oxigenada], mas o processo é 100 mil vezes mais lento do que no caso do hidroperóxido de ácido araquidônico”, contou Netto.
Segundo o pesquisador, a reação química ocorreu na escala de milissegundos quando a enzima foi incubada com os hidroperóxidos de ácidos graxos. Já com outros tipos de hidroperóxidos o processo ocorreu na escala de minutos.
Uma surpresa para o grupo nessa etapa foi observar que, em contato com o peroxinitrito, a enzima agia com a mesma eficiência observada com os hidroperóxidos de ácido araquidônico e o ácido linoleico – algo não previsto nas simulações computacionais.
“O peroxinitrito é um produto formado por dois outros radicais: o superóxido e o óxido nítrico. É liberado tanto por plantas quanto mamíferos em resposta à infecção por patógenos”, explicou o pesquisador.
Inibição do crescimento
O passo seguinte foi a realização de ensaios microbiológicos e, para isso, o grupo do IB-USP usou linhagens de bactérias da espécie Pseudomonas aeruginosa, que em humanos costuma causar infecções oportunistas, por exemplo, no sistema respiratório.
“Comparamos um grupo de bactérias mutantes, que tiveram o gene da Ohr deletado, com bactérias selvagens [capazes de produzir a enzima]. Os dois grupos foram colocados em diferentes concentrações de hidroperóxidos para testar sua resistência”, contou Netto.
Enquanto as bactérias selvagens conseguiam crescer mesmo em altas concentrações de hidroperóxidos, as linhagens mutantes paravam de se multiplicar mesmo nas doses mais baixas. Porém, quando o gene da Ohr foi inserido novamente na linhagem mutante, essas bactérias voltaram a mostrar resistência aos oxidantes em nível comparável ao das células selvagens.
Conforme explicou Netto, ao longo do processo evolutivo, as bactérias desenvolveram um grande repertório de proteínas antioxidantes para lidar com as defesas dos organismos hospedeiros – entre elas destacam-se as enzimas peroxirredoxinas e catalases.
Os testes feitos na USP mostraram que outras bactérias mutantes, com a deleção dessas outras enzimas antioxidantes, não apresentaram a mesma sensibilidade aos hidroperóxidos de ácidos graxos e ao peroxinitrito que a observada na linhagem mutante sem Ohr. Na avaliação de Netto, esse dado sugere que a Ohr tem papel central na defesa antioxidante bacteriana.
Peroxirredoxina
Em outro trabalho, publicado na revista Scientific Reports, o grupo de Netto em colaboração com o grupo do professor Marcos Antonio de Oliveira, da Universidade Estadual Paulista (Unesp), Campus Experimental do Litoral Paulista, estudou outra enzima antioxidante: a peroxirredoxina.
Essas proteínas são capazes de neutralizar muito rapidamente o peróxido de hidrogênio. Por serem muito abundantes e reativas, disse Netto, são consideradas os sensores celulares de peróxido de hidrogênio.
“Nos últimos anos, o peróxido de hidrogênio tem deixado de ser visto apenas como um vilão, que serve para oxidar proteínas, DNA e causar dano celular. Estudos recentes têm mostrado que ele também atua como agente sinalizador e, para isso, precisa haver interação com peroxirredoxinas”, contou o pesquisador.
Como explicou Netto, alguns tipos de câncer e de doenças neurodegenerativas podem estar ligados a falhas nessa sinalização mediada pelo peróxido de hidrogênio. “As peroxirredoxinas, ao modular o nível de peróxido nas células, atuam indiretamente na manutenção da homeostase celular redox, cuja desregulação está envolvida em diversas doenças de caráter genético ou infeccioso”, explicou.
Esse estudo fez parte da tese de doutorado de Carlos Abrunhosa Tairum Junior, na Unesp, com apoio da FAPESP.
No trabalho publicado na Scientific Reports, os pesquisadores mostraram o papel catalítico-estrutural de aminoácidos Treonina/Serina, que são completamente conservados em todas as peroxirredoxinas. “Esses aminoácidos modulam grandes alterações estruturais em peroxirredoxinas, com repercussões na atividade catalítica”, disse Netto.
O artigo “Catalytic Thr or Ser Residue Modulates Structural Switches in 2-Cys Peroxiredoxin by Distinct Mechanisms” pode ser lido em: http://www.nature.com/articles/srep33133.
Já o artigo “Ohr plays a central role in bacterial responses against fatty acid hydroperoxides and peroxynitrite” pode ser acessado pelo endereço: http://www.pnas.org/content/114/2/E132.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.




