

Resultados publicados na PNAS por pesquisadores da USP em Ribeirão Preto abrem caminho para o desenvolvimento de inibidores que poderão ser testados em parasitas (imagem: Divulgação)
Resultados publicados na PNAS por pesquisadores da USP em Ribeirão Preto abrem caminho para o desenvolvimento de inibidores que poderão ser testados em parasitas
Resultados publicados na PNAS por pesquisadores da USP em Ribeirão Preto abrem caminho para o desenvolvimento de inibidores que poderão ser testados em parasitas
Resultados publicados na PNAS por pesquisadores da USP em Ribeirão Preto abrem caminho para o desenvolvimento de inibidores que poderão ser testados em parasitas (imagem: Divulgação)
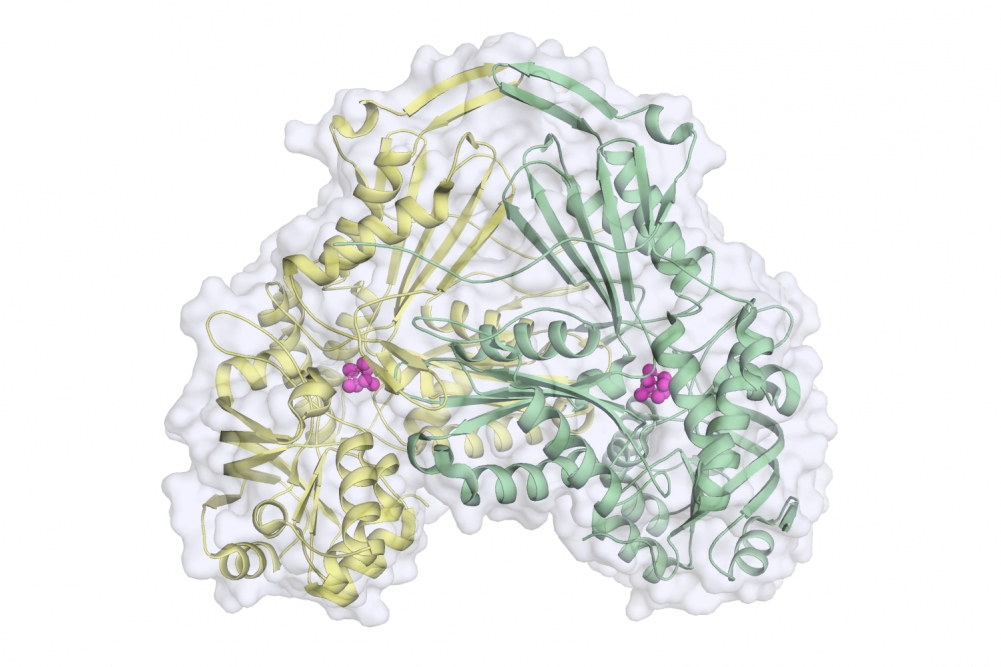
Karina Toledo | Agência FAPESP – Em artigo publicado na revista Proceedings of the National Academy of Sciences (PNAS), pesquisadores da Universidade de São Paulo (USP) descreveram a estrutura de uma enzima importante para o metabolismo do protozoário Leishmania major, causador de leishmaniose cutânea.
Segundo os autores, os resultados da pesquisa – apoiada pela FAPESP – abrem caminho para o desenvolvimento de medicamentos que poderão ser úteis tanto no tratamento dos diversos tipos de leishmaniose como também da doença de Chagas e da doença do sono (tripanossomíase africana).
“A proteína encontrada na L. major é muito parecida com a existente no Trypanossoma cruzi
Conhecida como fumarato hidratase, a proteína descrita no artigo é responsável por catalisar a conversão reversível de malato em fumarato – metabólitos importantes para a sobrevivência do parasita.
Em humanos, sua deficiência está relacionada a diversas patologias, como a acidúria fumárica, considerada um erro inato do metabolismo e caracterizada por perda de tônus muscular, retardo psicomotor e convulsões, entre outros sintomas. Outros exemplos são leiomiomatose cutânea e uterina (neoplasias benignas da musculatura lisa) e carcinoma renal.
No artigo, os pesquisadores mostraram que, ao se enovelar, essa proteína assume um formato tridimensional nunca antes descrito na literatura científica, que lembra o desenho de um coração. Também foram identificados durante a pesquisa os principais resíduos de aminoácidos envolvidos na reação catalítica. Esse conhecimento, segundo Nonato, permite desenvolver inibidores da atividade enzimática que poderão ser testados para avaliação do seu efeito antiparasitário.
Sensível a oxigênio
O trabalho começou durante os projetos de mestrado e doutorado de Patrícia Rosa Feliciano, sob a orientação de Nonato. Nessa época, foram desenvolvidas as metodologias para clonar a proteína, expressá-la em bactérias e purificá-la.
Mas o avanço só foi possível graças a uma parceria firmada com a pesquisadora Catherine Drennan, do Massachusetts Institute of Technology (MIT), nos Estados Unidos. Isso porque a fumarato hidratase tem sua atividade inibida em contato com oxigênio. Para estudá-la mais profundamente, portanto, é necessária uma estrutura conhecida como glove box – uma câmara hermeticamente fechada cujo interior só pode ser acessado por meio de luvas. Dentro da câmara, é inserido nitrogênio para expurgar todo o conteúdo de oxigênio de seu interior.
“Ainda não temos no Brasil uma infraestrutura ideal para trabalhar com proteínas sensíveis ao oxigênio. Todo o processo de purificação e de cristalização para a determinação da estrutura foi feito no MIT, em parceria com Drennan e com auxílio de uma Bolsa da FAPESP para estágio no exterior”, contou Nonato.
Com a proteína purificada e cristalizada, o grupo conseguiu investigar sua estrutura tridimensional usando uma técnica conhecida como cristalografia por difração de raios X.
“Pela forma como o cristal de proteína difrata a radiação emitida sobre ele é possível descobrir o tipo de átomo presente e sua posição na molécula. Existe, portanto, uma correlação entre o conteúdo atômico e o padrão de difração e usamos essa informação para reconstruir a estrutura da proteína. Como o cristal contém inúmeras cópias da mesma molécula, isso ajuda a amplificar o sinal”, explicou Nonato.
Em seguida, o grupo criou versões mutantes da proteína, que também tiveram sua estrutura cristalográfica investigada e o mecanismo catalítico mapeado. Os dados dessa segunda parte da pesquisa devem ser publicados em breve.
“Já desenvolvemos até mesmo um inibidor que está funcionando bem, mas ainda não temos os resultados de seus efeitos nos parasitas”, contou Nonato.
Em estudos anteriores, o grupo já havia mostrado que são encontradas na L. major duas isoformas da fumarato hidratase – uma na mitocôndria e outra no citosol (líquido que preenche o citoplasma celular). Segundo Nonato, a isoforma mitocondrial estaria envolvida na produção de energia para o parasita.
“O interessante é que são duas proteínas muito parecidas, mas com papéis distintos no organismo. Quando você as inibe, portanto, interfere em mais de uma via metabólica. Acreditamos que, dessa forma, pode desencadear efeitos maiores do que drogas que interferem em uma única via”, avaliou a pesquisadora.
A leishmaniose tegumentar ou cutânea é transmitida para humanos pela picada do mosquito-palha (gênero Lutzomyia) e sua principal característica é o surgimento de úlceras na pele e nas mucosas das vias aéreas superiores.
No Brasil, a doença é causada principalmente por protozoários da espécie L. braziliensis. No entanto, Nonato desenvolveu o estudo com a espécie L. major por ter sido a primeira a ter o genoma sequenciado.
Há ainda outras espécies de protozoários do mesmo gênero que causam a leishmaniose visceral, considerada uma das seis parasitoses mais importantes em humanos.
O artigo Crystal structure of an Fe-S cluster-containing fumarate hydratase enzyme from Leishmania major reveals a unique protein fold (doi: 10.1073/pnas.1605031113) pode ser lido em www.pnas.org/content/113/35/9804.abstract.
Mais imagens e informações sobre a enzima fumarato hidratase da espécie L. major podem ser consultadas no site do Laboratório de Cristalografia de Proteínas: www.lcprp.com.br.
Republicar
A Agência FAPESP licencia notícias via Creative Commons (CC-BY-NC-ND) para que possam ser republicadas gratuitamente e de forma simples por outros veículos digitais ou impressos. A Agência FAPESP deve ser creditada como a fonte do conteúdo que está sendo republicado e o nome do repórter (quando houver) deve ser atribuído. O uso do botão HMTL abaixo permite o atendimento a essas normas, detalhadas na Política de Republicação Digital FAPESP.





