
Muchos pacientes exhiben una merma significativa de la inmunidad que perdura durante años después del alta hospitalaria. En un artículo publicado en la revista Immunity, investigadores brasileños revelan el rol de los plamoblastos en esta esta susceptibilidad (imagen: archivo de los investigadores)
Muchos pacientes exhiben una merma significativa de la inmunidad que perdura durante años después del alta hospitalaria. En un artículo publicado en la revista Immunity, investigadores brasileños revelan el rol de los plamoblastos en esta susceptibilidad
Muchos pacientes exhiben una merma significativa de la inmunidad que perdura durante años después del alta hospitalaria. En un artículo publicado en la revista Immunity, investigadores brasileños revelan el rol de los plamoblastos en esta susceptibilidad

Muchos pacientes exhiben una merma significativa de la inmunidad que perdura durante años después del alta hospitalaria. En un artículo publicado en la revista Immunity, investigadores brasileños revelan el rol de los plamoblastos en esta esta susceptibilidad (imagen: archivo de los investigadores)
Por Karina Toledo | Agência FAPESP – La sepsis es la principal causa de muerte en las unidades de terapia intensiva (UTI) de Brasil. Entre los pacientes que evolucionan hacia la forma grave de esta enfermedad, fallece el 40 %. Y los sobrevivientes suelen padecer secuelas cardiovasculares y neurológicas, aparte de una disminución significativa en la inmunidad que perdura durante años tras el alta hospitalaria.
“Los estudios sugieren que los sobrevivientes de la sepsis están sujetos a un riesgo seis veces mayor de desarrollar infecciones graves cuando se los compara con individuos que nunca padecieron esta enfermedad. Quedan susceptibles incluso a la acción de patógenos oportunistas, que no suelen causar enfermedades en personas sanas. Estamos empezando a entender por qué sucede esto”, comenta José Carlos Farias Alves Filho, docente de la Universidad de São Paulo (USP), en Brasil, y coordinador de un estudio sobre el tema que ha salido publicado en la revista Immunity, de Cell Press, en declaraciones concedidas a Agência FAPESP.
La sepsis, popularmente denominada infección generalizada, es a decir verdad una inflamación sistémica que comúnmente se desencadena debido a una infección localizada que sale de control. En el intento de eliminar al agente patogénico –que puede ser una bacteria, un hongo o incluso un virus, tal como el SARS-CoV-2–, el sistema inmunitario empieza a producir excesivamente sustancias inflamatorias que perjudican al propio organismo. En los pacientes con la forma grave, se producen lesiones en órganos vitales, caída de la presión arterial y –en última instancia– un cuadro de falencia circulatoria conocido como choque séptico.
Para entender cómo esto deriva en la inmunosupresión, el grupo que Farias Alves Filho coordina efectuó una serie de experimentos con ratones y con células inmunitarias extraídas de la sangre de pacientes sépticos. Esta investigación estuvo a cargo de la posdoctoranda Daniele Carvalho Bernardo Nascimento, becaria de la FAPESP. Dichos científicos forman parte del equipo del Centro de Investigaciones en Enfermedades Inflamatorias (CRID), un Centro de Investigación, Innovación y Difusión (CEPID) de la FAPESP con sede en la Facultad de Medicina de Ribeirão Preto (FMRP-USP).
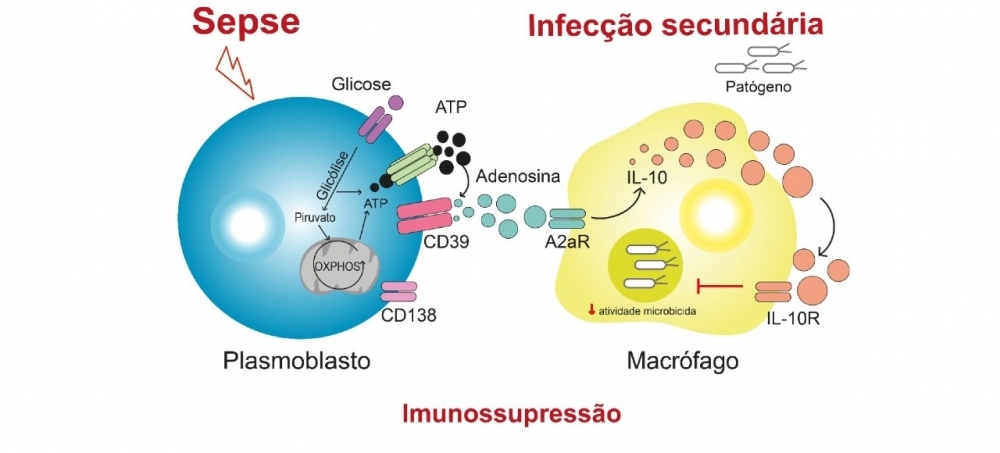
“Resumidamente, nuestros resultados revelan que la sepsis induce la proliferación de una subpoblación de linfocitos B que expresa grandes cantidades de CD39, una enzima que rompe la molécula de ATP [trifosfato de adenosina, el ‘combustible’ químico de las células] y libera adenosina en la circulación. A su vez, este aumento de la concentración circulante de adenosina hace que disminuya la actividad de los macrófagos, que son células de defensa encargadas de fagocitar bacterias, hongos y otras potenciales amenazas contra el organismo”, comenta Farias Alves Filho.
Tal como lo explica el investigador, ya se sabía al respecto de la elevación de los niveles de adenosina durante el período inicial de la sepsis, como así también sobre su efecto inmunosupresor. La adenosina se une a un receptor presente en la superficie de los macrófagos llamado A2aR, induciendo la producción de interleuquina-10 (IL-10), una molécula con acción antiinflamatoria.
La novedad del presente estudio consistió en demostrar que la adenosina cumple un papel central en el desarrollo de la inmunosupresión posterior a la sepsis y revelar cuáles son las células que constituyen la fuente de esa adenosina extra presente en la sangre de animales y de pacientes sépticos.
“Todas las células del sistema inmunitario expresan CD39 en distintos niveles. Pero observamos que existe un subtipo de linfocitos B denominados plasmoblastos que produce grandes cantidades de dicha enzima. Nosotros detectamos que esos plasmoblastos proliferan mucho después de la sepsis y sufren una reprogramación metabólica. Pasan a consumir más glucosa y, por consiguiente, comienzan también a producir más ATP. Al mismo tiempo, expresan grandes cantidades de la enzima [CD39] que realiza la hidrólisis del ATP y libera adenosina. Es como si los soldados se volvieran capaces de producir sus propias municiones”, compara el investigador.
Experimentos
Para inducir la sepsis grave en ratones, los científicos recurrieron a un modelo conocido como ligadura y punción cecal (CLP, por sus siglas en inglés), que consiste en efectuar pequeños orificios en el intestino de los animales para permitir la salida de la materia fecal y de bacterias hacia la cavidad peritoneal. Este procedimiento simula lo que sucede con los pacientes con apendicitis supurada. Los animales que sobrevivieran a la sepsis fueron objeto de un seguimiento por 90 días y, durante todo ese lapso de tiempo, se mostraron altamente susceptibles a la acción de patógenos oportunistas. Cuando se los expuso a la bacteria Legionella pneumophila, ninguno sobrevivió. En el caso del hongo Aspergillus fumigatus, restó únicamente el 20 %.
Para confirmar la importancia de la adenosina en el cuadro de inmunosupresión posterior a la sepsis, se realizaron experimentos con fármacos capaces de inhibir la acción de la enzima CD39 o la del receptor de adenosina A2aR. Entre los animales sometidos a este “tratamiento” antes de la exposición a los patógenos oportunistas, el porcentaje de sobrevivientes se elevó al 60 %.
Cuando ese mismo experimento se llevó a cabo con animales genéticamente modificados para no expresar la enzima CD39 o el receptor A2aR, los sobrevivientes llegaron al 70 %.
Al analizar la sangre de los pacientes sépticos internados en el Hospital de Clínicas de la FMRP-USP, los investigadores notaron que, cuanto más grave era el cuadro, más altos eran los niveles de adenosina circulantes y mayor era también la cantidad de plasmoblastos que expresaban CD39.
Se realizaron otras diversas pruebas con ratones para dilucidar paso por paso el mecanismo inmunosupresor. En una de estas, se les aplicó a animales sanos una infusión de plasmoblastos extraídos de animales sépticos y, como consecuencia de ello, los primeros se volvieron más susceptibles a la acción de los patógenos oportunistas.
Y un experimento análogo se concretó con células humanas. Los macrófagos aislados en voluntarios sanos se incubaron con plasmoblastos de pacientes sépticos y con una bacteria oportunista. Debido a la acción de la adenosina, las células de defensa se volvieron incapaces de matar a los microorganismos.
Lagunas
Pero un interrogante sigue abierto: ¿mediante qué mecanismos la sepsis provoca la proliferación de los linfocitos B productores de CD39? Y otra tarea futura consistirá en seguir de cerca a los pacientes que sobrevivan a la sepsis grave para evaluar si los niveles de adenosina circulantes siguen elevados durante largos períodos, tal como sucede con los ratones.
En un trabajo anterior, publicado en Nature Communications en 2017, el grupo encabezado por Farias Alves Filho había demostrado que la sepsis induce la proliferación de otro tipo de células inmunosupresoras conocidas como linfocitos T reguladores o Treg (lea más en: agencia.fapesp.br/25174).
“Ya habíamos demostrado que la sepsis genera un incremento de linfocitos T reguladores de manera dependiente de IL-10. En el actual estudio, demostramos que la adenosina producida por los plasmoblastos es un mediador que lleva a la producción de IL-10 en los macrófagos en sobrevivientes a la sepsis. Por ende, estos dos trabajos se conectan: los plasmoblastos inducen la producción de IL-10 a cargo de los macrófagos que, a su vez, puede promover la expansión de linfocitos T reguladores, amplificando el estado inmunosupresivo de esas personas”, comenta Carvalho Bernardo Nascimento.
Según la posdoctoranda, la identificación de este nuevo mecanismo allana el camino en la búsqueda de intervenciones que puedan revertir este cuadro. “Creemos que, si logramos inhibir la expansión de los plasmoblastos, podremos disminuir la inmunosupresión, con la consiguiente elevación de la expectativa de vida de las personas que sobreviven a la sepsis.”
Puede leerse el artículo intitulado Sepsis expands a CD39+ plasmablast population that promotes immunosuppression via adenosine-mediated inhibition of macrophage antimicrobial activity en el siguiente enlace: www.sciencedirect.com/science/article/abs/pii/S1074761321003356?via%3Dihub.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.




