
Se trata una técnica de aplicación de infrarrojo cuyo objetivo es liberar materiales fotoactivos y antitumorales en el interior del organismo e inducir la muerte por hipertermia de las células cancerosas (imagen: GNano-IFSC-USP)
Se trata una técnica de aplicación de infrarrojo cuyo objetivo es liberar materiales fotoactivos y antitumorales en el interior del organismo e inducir la muerte por hipertermia de las células cancerosas
Se trata una técnica de aplicación de infrarrojo cuyo objetivo es liberar materiales fotoactivos y antitumorales en el interior del organismo e inducir la muerte por hipertermia de las células cancerosas

Se trata una técnica de aplicación de infrarrojo cuyo objetivo es liberar materiales fotoactivos y antitumorales en el interior del organismo e inducir la muerte por hipertermia de las células cancerosas (imagen: GNano-IFSC-USP)
Por Elton Alisson, desde São Carlos (Brasil) | Agência FAPESP – Científicos del Grupo de Nanomedicina y Nanotoxicología (GNano), del Instituto de Física de São Carlos de la Universidad de São Paulo (IFSC-USP), en Brasil, desarrollaron un método optimizado para el tratamiento de tumores basado en el uso del calor que la luz produce (fototermia).
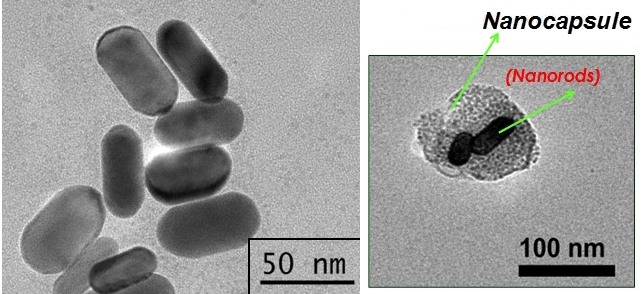
Esta técnica consiste en el empleo de nanocápsulas elaboradas con membranas extraídas de células cancerosas para transportar sustancias antitumorales y materiales fotoactivos (activados mediante la luz) a escala nanométrica (de la milmillonésima parte del metro) hasta un tumor. Al irradiárselas con luz infrarroja, estas nanocápsulas de membrana se rompen y liberan el material presente en su interior. El calor que la luz genera promueve el calentamiento del material fotoactivo e induce así la muerte de las células tumorales por hipertermia.
Este trabajo se desarrolló en el marco del doctorado de Valéria Spolon Marangoni, becaria de la FAPESP. Y los resultados de la aplicación del método en el tratamiento del cáncer de vejiga en animales se dieron a conocer durante el Simposio de Investigación e Innovación en Materiales Funcionales, organizado por el Centro de Desarrollo de Materiales Funcionales (CDMF) durante los días 23 y 24 mayo en la Universidad Federal de São Carlos (UFSCar).
El CDMF es un Centro de Investigación, Innovación y Difusión (CEPID) que cuenta con el apoyo de la FAPESP.
“Desarrollamos un nanocargador que potencialmente podría servir para mejorar el transporte, la liberación y la activación de los fármacos que se aplican en el tratamiento del cáncer mediante fototermia”, dijo Valtencir Zucolotto, docente del IFSC-USP y director de la investigación, durante el referido evento.
El nuevo sistema se desarrolló a partir de nanopartículas elaboradas con materiales denominados teranósticos –con aplicaciones simultáneas en terapia y en diagnóstico– que los investigadores desarrollaron durante los últimos años.
Al introducírselas en el sistema circulatorio, esas nanopartículas tienden a migrar y a incorporarse a las células tumorales. Su localización en el organismo puede mapearse mediante tomografía, resonancia magnética o espectroscopía fotoacústica, por ejemplo.
Una vez que se las visualiza, es posible promover el calentamiento de dichas nanopartículas con magneto –en caso de que posean núcleos magnéticos, de magnetita, por ejemplo– o mediante fototermia, a los efectos de promover la muerte por hipertermia de las células tumorales a las cuales están incorporadas.
“Al irradiárselas con luz infrarroja, las nanopartículas de óxido de grafeno incubadas en células Hela [un tipo de célula ‘inmortal’, que puede cultivarse en laboratorio indefinidamente], por ejemplo, promueven un calentamiento de entre ocho y 12 grados en esas células, con lo cual se las induce la muerte”, dijo Zucolotto.
Nanobastones de oro
Además del grafeno, los científicos han venido utilizando oro para crear las nanopartículas teranósticas en forma de estrellas y de bastones. Con estos formatos, según explicaron, el nanomaterial se vuelve capaz de absorber luz en el rango del infrarrojo y promover el calentamiento.
Las nanopartículas de oro con forma esférica, pese de ser muy buenas para aplicárselas en sistemas de entrega de fármacos [drug delivery], absorben luz únicamente en la región visible del espectro electromagnético. “Esto impide su uso en fototermia, pues la luz visible no atraviesa los tejidos como lo hace la luz infrarroja”, comparó Zucolotto.
Sin embargo, en los últimos años los ingenieros de materiales descubrieron que al “estirar” un poco las nanopartículas esféricas de oro, estas adquirían la forma de bastones, lo cual les confiere un modo vibracional electrónico longitudinal que permite la absorción de la luz en el espectro infrarrojo.
Con base en este descubrimiento, los investigadores del IFSC-USP empezaron a producir nanobastones de oro y a probarlos en el tratamiento con fototermia de algunos tipos de cáncer.
Para transportar esos compuestos hasta las células blancos –o dianas− se desarrollaron nanocápsulas elaboradas con membranas celulares cultivadas en laboratorio, obtenidas de linajes de tumores de pulmones, por ejemplo.
En la actualidad, la mayoría de las nanocápsulas que se emplean en el transporte de fármacos y moléculas dentro del organismo para llevarlas hasta regiones específicas o dentro de células se fabrican con base en lípidos y polímeros.
Según Zucolotto, el transporte de compuestos mediante nanocápsulas elaboradas con membranas de células es más eficiente pues estas están constituidas por el mismo material que las células diana.
“Como las nanocápsulas de membrana celular tienen una composición muy parecida a las de las células tumorales, con proteínas tales como las galectinas, el reconocimiento y la adherencia entre ellas se ve facilitado. Esto permite que las nanocápsulas tengan una interacción mayor con las células diana y logren entregar con mayor eficiencia el material que cargan”, dijo.
Mediante mejoras en la técnica de obtención de estas nanocápsulas, los científicos han logrado poner una mayor cantidad de nanobastones de oro y de antitumorales en su interior.
En un estudio reciente, publicado en la revista Applied Bio Materials, los investigadores aplicaron nanobastones de oro y el quimioterapéutico betalapaxona, envueltos en nanocápsulas de membrana celular, para tratar tumores de vejiga inducidos en ratones.
Los resultados de esos experimentos, realizados en colaboración con el profesor Wagner José Fávaro, del Instituto de Biología de la Universidad de Campinas – IB-Unicamp (en el estado de São Paulo, Brasil), mostraron que las nanocápsulas se unieron a los tumores. Al irradiárselas con luz infrarroja una sola vez durante dos minutos, las cápsulas de membrana se rompieron y liberaron los nanobastones de oro y la betalapaxona entre diez y 20 minutos después de que comenzara el proceso.
Los análisis de los tejidos también revelaron que ninguno de los tumores de vejiga de los animales creció, y algunos incluso se reabsorbieron.
“Constatamos que este método de tratamiento promovió la destrucción de las células cancerosas mediante fototermia y quimioterapia en forma sinérgica”, dijo Zucolloto.
Puede leerse el artículo intitulado Photothermia and activated drug release of natural cell membrane coated plasmonic gold nanorods and β-Lapachone (DOI: 10.1021/acsabm.8b00603), de Valéria S. Marangoni, Juliana Cancino Bernardi, Ianny B. Reis, Wagner J. Fávaro y Valtencir Zucolotto, en la revista Applied Bio Materials, en el siguiente enlace: pubs.acs.org/doi/10.1021/acsabm.8b00603.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.




