
El compuesto controla la elevación de la presión en casos relacionados con hiperactividad simpática. Los resultados de los ensayos preclínicos se publicaron en la revista Nature Medicine (imagen: Gray's anatomy book/ Wikimedia Commons)
El compuesto controla la elevación de la presión en casos relacionados con hiperactividad simpática. Los resultados de los ensayos preclínicos se publicaron en la revista Nature Medicine
El compuesto controla la elevación de la presión en casos relacionados con hiperactividad simpática. Los resultados de los ensayos preclínicos se publicaron en la revista Nature Medicine

El compuesto controla la elevación de la presión en casos relacionados con hiperactividad simpática. Los resultados de los ensayos preclínicos se publicaron en la revista Nature Medicine (imagen: Gray's anatomy book/ Wikimedia Commons)
Por Karina Toledo | Agência FAPESP – Con el apoyo de la FAPESP, un grupo que reúne a científicos brasileños, ingleses y neozelandeses está probando un medicamento capaz de combatir la hipertensión arterial mediante un mecanismo innovador.
Los resultados más recientes de los ensayos preclínicos con este compuesto –por ahora denominado MK-7264/AF-219– se publicaron en septiembre en la revista Nature Medicine.
Los ensayos en humanos se están planificando en Inglaterra. En caso de que esta terapia se muestre eficaz y segura, podrá beneficiar también a pacientes con hipertensión resistente, es decir, que no responden a los tratamientos farmacológicos disponibles actualmente.
“Este nuevo medicamento actúa al bloquear la acción de un tipo de receptores celulares conocidos como P2X3 o receptores purinérgicos, presentes en un órgano llamado corpúsculo carotídeo, situado en las arterias carótidas. Esas células se encuentran anormalmente activadas en individuos hipertensos”, explicó Benedito Honorio Machado, docente del Departamento de Fisiología de la Facultad de Medicina de Ribeirão Preto, dependiente de la Universidad de São Paulo (FMRP-USP), en Brasil.
El medicamento se desarrolló en el laboratorio Afferent Pharmaceuticals, que actualmente pertenece a Merck, con base en resultados de investigaciones realizadas a lo largo de las últimas décadas por los grupos coordinados por Honorio Machado, en la USP, y por el profesor Julian Paton, en la Universidad de Bristol, Inglaterra. Mediante una cooperación que dura ya más de 15 años, se llevaron a cabo estudios relacionados con la caracterización de los receptores purinérgicos y con el control cardiovascular. También colaboraron científicos de la Universidad de Auckland, en Nueva Zelandia.
Tal como explicó Honorio Machado, este medicamento impide que el receptor P2X3 sea activado por su agente “ligando” –en este caso, el ATP (trifosfato de adenosina, una molécula que almacena energía destinada a las actividades celulares). Esto hace que las células del corpúsculo carotídeo, que en los hipertensos son hiperactivas, retornen al patrón de actividad que se considera normal.
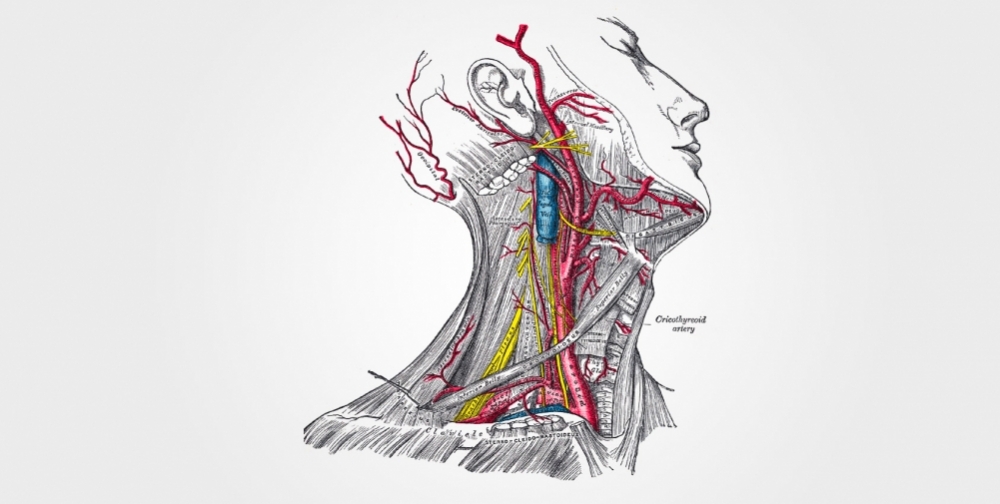
El corpúsculo carotídeo, que tiene el tamaño de un grano de arroz, es considerado el menor órgano del cuerpo humano. Existen en realidad dos corpúsculos carotídeos, uno en cada arteria carótida, por donde se transporta la sangre rica en oxígeno proveniente del corazón hacia el cerebro.
“Los corpúsculos carotídeos se ubican en la región del cuello, donde las arterias carótidas se bifurcan. Funcionan como sensores que alertan al sistema nervioso central cuando –por algún motivo– el nivel de oxígeno disminuye en la sangre. Cuando esa señal de alerta llega al cerebro, se desencadena una respuesta de aumento de la actividad simpática, que hace aumentar la frecuencia cardíaca y la resistencia vascular al paso del flujo sanguíneo y provoca un aumento de la presión arterial. Se produce también un aumento de la respiración para aumentar el aporte de oxígeno al cerebro”, comentó Honorio Machado.
Es un sistema de defensa necesario durante un episodio de apnea obstructiva del sueño, por ejemplo. La caída de la oxigenación genera la activación de las células del corpúsculo carotídeo, que envían la señal de alerta al cerebro.
En condiciones fisiológicas luego de la normalización del nivel de oxígeno de la sangre, la actividad simpática vuelve a lo normal, como así también la presión arterial. Pero experimentos realizados con ratas en la FMRP-USP indicaron que, en animales hipertensos, estas células mandan constantemente señales al cerebro para aumentar la actividad simpática.
“Todos los medicamentos contra la hipertensión actualmente disponibles en el mercado interfieren en los efectos finales de esa hiperactividad simpática, es decir, en las terminaciones neurales de los vasos y del corazón, induciendo la vasodilatación y la caída de la presión arterial. Este nuevo medicamente combatirá la hipertensión en su origen, evitando el aumento de la actividad simpática”, afirmó Honorio Machado.
Los ensayos
En los experimentos realizados en la USP por el profesor Davi José de Almeida Moraes y por la investigadora Melina Pires da Silva, ambos del Departamento de Fisiología de la FMRP, se utilizó un linaje de ratas que espontáneamente se vuelven hipertensas a partir de las cinco semanas de vida, producto de años de cruzamientos entre animales con presión arterial elevada.
Para medir el nivel de actividad de las células de los corpúsculos carotídeos en distintas situaciones, los investigadores emplearon técnicas de electrofisiología: mediante el uso de microelectrodos, midieron la actividad de un grupo de neuronas –localizadas en ganglios de la región del pescuezo de las ratas– encargadas de llevar las señales emitidas por el corpúsculo carotídeo hasta el cerebro.
“Mediante el registro de la actividad neural, observamos que las células del corpúsculo carotídeo de los animales hipertensos están continuamente más activadas que las de los animales de control. Asimismo, cuando los animales son sometidos a una situación de merma de oxígeno, las células de los hipertensos responden de manera más exacerbada”, comentó Almeida Moraes.
En un intento de develar la causa de esta mayor excitabilidad, los investigadores decidieron estudiar los receptores de tipo P2X3. Notaron que además de estar más expresados en las células de las ratas hipertensas, también responden exageradamente cuando se aplica el ATP en la zona.
Mediante análisis histológicos, se demostró en este estudio que estos receptores también se expresan en las células de los corpúsculos carotídeos humano.
El paso siguiente consistió en poner a prueba el efecto del tratamiento con el bloqueador del P2X3 en animales. Inicialmente, se aplicó el compuesto MK-7264/AF-219 directamente en los corpúsculos carotídeos de las ratas hipertensas y, mediante el registro de la actividad neural, el grupo observó una disminución de la actividad de esas neuronas y también de la actividad simpática.
El efecto del medicamento sobre la presión arterial se testeó mediante un tratamiento agudo, realizado por vía endovenosa. A los animales hipertensos se les aplicó una infusión del bloqueador durante 60 minutos, y luego se les monitoreó la presión durante una hora más.
“Durante ese lapso, los valores presóricos se mantuvieron similares a los de animales normotensos. Posteriormente, la presión arterial tiende a volver a niveles elevados. Para potenciar el efecto en los ensayos clínicos, será necesario planificar cuidadosamente la dosis destinada a la administración oral”, comentó Almeida Moraes.
Un primer indicio que indica que esta nueva estrategia terapéutica puede funcionar en humanos también se demostró en el estudio publicado en Nature Medicine. En un experimento realizado en Inglaterra, pacientes hipertensos recibieron por vía endovenosa durante cinco minutos el neurotransmisor dopamina, una sustancia capaz de inhibir la actividad del corpúsculo carotídeo. Este tratamiento provocó una disminución de la respiración de los voluntarios, lo que indica que en humanos hipertensos los corpúsculos carotídeos también se encuentran hiperactivos.
“Creemos que esta estrategia, mediante la utilización de dopamina, podrá ayudar en el futuro a identificar qué pacientes podrán beneficiarse con los bloqueadores de P2X3. No todos los casos de hipertensión están relacionados con la hiperactividad de las células del corpúsculo carotídeo”, comentó Almeida Moraes.
De acuerdo con el investigador, la remoción quirúrgica de uno de los corpúsculos carotídeos se ha testeado en la Inglaterra como un tratamiento en casos de hipertensión maligna, aquéllos que no se pueden controlar con medicamentos. En la mayoría de los pacientes sometidos a este procedimiento, se observó una disminución de la presión arterial y una mejora de la calidad de vida.
“La desventaja de este método reside en que implica una cirugía en una zona sumamente delicada. Además, no se puede remover ambos corpúsculos carotídeos, pues el paciente correría el riesgo de morir durante un episodio de apnea del sueño, por ejemplo. En tanto, con el bloqueador de P2X3, el sistema de alarma del organismo sigue funcionando, solamente deja de estar más activado de lo que debería”, dijo Honorio Machado.
Mientras tanto, existen ensayos clínicos en marcha con el compuesto MK-7264/AF-219 para el tratamiento de la tos crónica, una condición también relacionada con la hiperactividad de los receptores purinérgicos. “El compuesto ha sido aprobado en los primeros test para la evaluación de su toxicidad, y se encuentra en una fase adelantada de los ensayos clínicos”, dijo Honorio Machado.
Puede leerse el artículo intitulado Purinergic receptors in the carotid body las a new drug target for controlling hypertension (doi: 10.1038/nm.4173), en el siguiente enlace: nature.com/nm/journal/vaop/ncurrent/full/nm.4173.html.
Republicar
The Agency FAPESP licenses news via Creative Commons (CC-BY-NC-ND) so that they can be republished free of charge and in a simple way by other digital or printed vehicles. Agência FAPESP must be credited as the source of the content being republished and the name of the reporter (if any) must be attributed. Using the HMTL button below allows compliance with these rules, detailed in Digital Republishing Policy FAPESP.




